P-手性膦化合物在农业化学、生物和制药工程等许多领域具有广泛的应用,而且是一类非常有前景的配体或有机催化剂。鉴于膦配体和有机催化剂在不对称催化中起到关键的作用,迫切需要发展有效的方法来制备含有P-立体中心的膦配体。传统的合成方法需要使用化学计量的手性原料或手性试剂,相比之下,不对称催化领域最近则取得了一些进展,主要基于两种策略,即二级膦或其氧化物的芳基化或烷基化以及前手性膦化合物的去对称化(图1a)。尽管取得了很大进展,但是对于多功能P-手性磷结构单元的对映选择性合成仍然非常有限。叔膦可以通过引入不同的取代基来调节其电子和空间性质,所以结构多样性的P-手性膦化合物库对于反应的发展十分有用。尽管目前已经报道过含有羟甲基或乙烯基的P-手性合成子,但是含有乙炔基的P-手性合成子却前所未见,对映选择性催化合成非常困难。
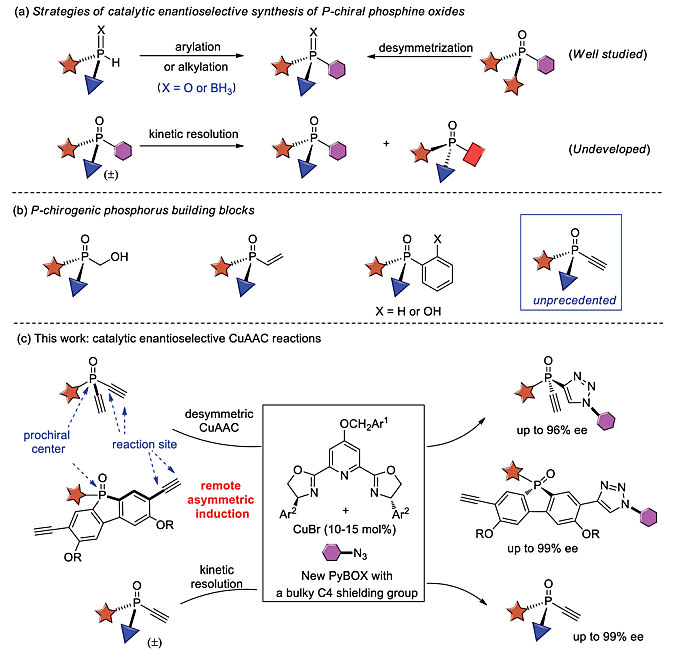
图1. 合成P-手性分子的方法。图片来源:Chem. Sci.
另一方面,虽然动力学拆分是获得手性原料的基本策略,但外消旋P-手性分子的催化动力学拆分却研究寥寥。目前只有Hayashi等人报道的磷杂环戊烯氧化物的动态动力学拆分(J. Am. Chem. Soc., 2017, 139, 8122)和Cramer等人报道的次磷酰胺的动力学拆分(Chem. Sci., 2018, 9, 2981)。近期,华东师范大学的周剑教授(点击查看介绍)课题组报道了Cu(I)-催化的叠氮-炔烃环加成(CuAAC)反应,通过去对称化和动力学拆分高对映选择性地合成了多样性的含有乙炔基的叔膦氧化物(图1C)。它可以进行各种多样化反应,以获得结构多样性的P-手性膦衍生物。相关工作发表在Chemical Science 上,第一作者是博士生朱仁义。
通常情况下,开发去对称化CuAAC的挑战在于实现优良对映选择性控制的同时如何抑制副产物双三唑类化合物的形成。另一方面,CuAAC在外消旋炔烃或叠氮化物的动力学拆分中的应用尚处于起步阶段。作者推测不对称的CuAAC是一种非常有前景的方法来制备含有乙炔基的P-手性合成子,该方法的优点包括:(1)二乙炔基膦氧化物1和单乙炔基膦氧化物4简单易得(一锅法,2-3步);(2)P-手性的膦氧化物3和4的实用性较好,它们可以作为有机催化剂以及各种P-手性膦衍生物的前体。况且有关含有三唑基的P-手性膦的性质未知,值得进一步的探索。
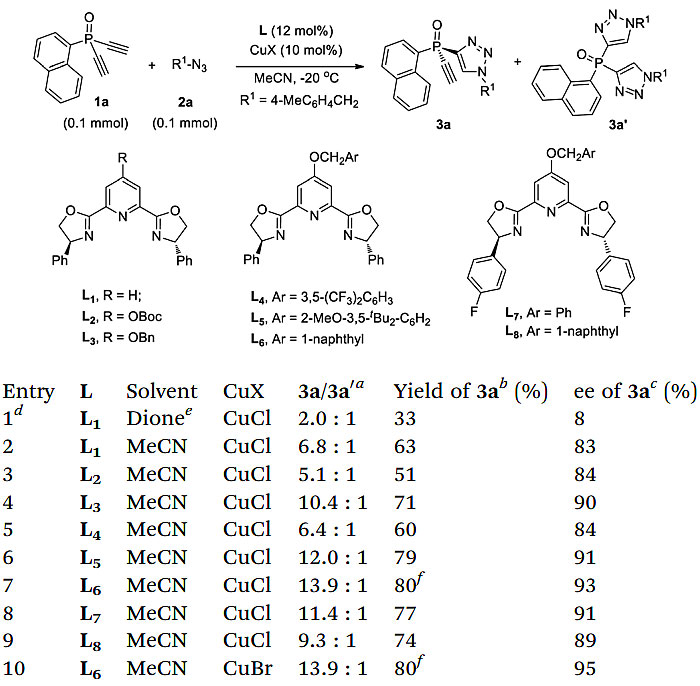
图2. 反应条件优化。图片来源:Chem. Sci.
作者开始尝试二炔1a和叠氮化物2a的去对称化CuAAC反应(图2)。值得一提的是,二乙炔基膦氧化物的去对称化此前还未见诸报道。带有端炔的前手性二炔是很难发生分子间去对称化反应,因为它们的线性结构使得它难以实现良好的对映选择性同时抑制双官能化副反应的发生。基于以往研究,作者先尝试了吡啶双噁唑啉(PYBOX)配体L1/CuCl作催化剂、2,5-己二酮作溶剂,但3a的ee 值仅为8%且3a/3a’比值仅为2.0:1。进一步的优化结果显示在MeCN中反应,3a的产率为63%,ee 值为83%,3a/3a’比值高达6.8:1。对于修饰的PYBOX L2-8,C4上带有合适的屏蔽基团有利于反应的进行。含缺电子苯基的配体L4结果较差,而带有富电子取代基的L5则提高了对映选择性和3a/3a’比。当使用含有1-萘甲氧基的配体L6时,3a/3a’比值进一步提高到13.9:1,同时3a的产率为80%,ee 值为93%。把CuCl改为CuBr可使ee 值提高到95%,而3a/3a’的比率则保持不变。
为了进一步探究L6的作用,作者评估了1a和2a反应的时间依赖性对映选择性。以往的研究表明,含前手性二芳基的二炔类化合物的CuAAC是去对称化和动力学拆分协同结合的过程,无论使用L1还是L6作为配体,3a的对映选择性随着反应转化率的增加而逐渐提高,而3a/3a’比值则逐渐降低。这表明,副产物3a’的形成有益于提高3a的ee 值。在手性催化剂存在的情况下,初始去对称化CuAAC生成的次要对映体(S)-3a的消耗速度快于主要对映体(R)-3a(图3)。因此,1a和2a的反应也是去对称化和动力学拆分的协同组合,其中k1>k2且k4>k3,有利于以高ee 值获得(R)-3a。值得注意的是,在去对称化和动力学拆分步骤中,使用配体L6时产物的ee 值优于L1。此外,配体L6在外消旋单三唑3a的动力学拆分中效果也优于L1(图3c)。
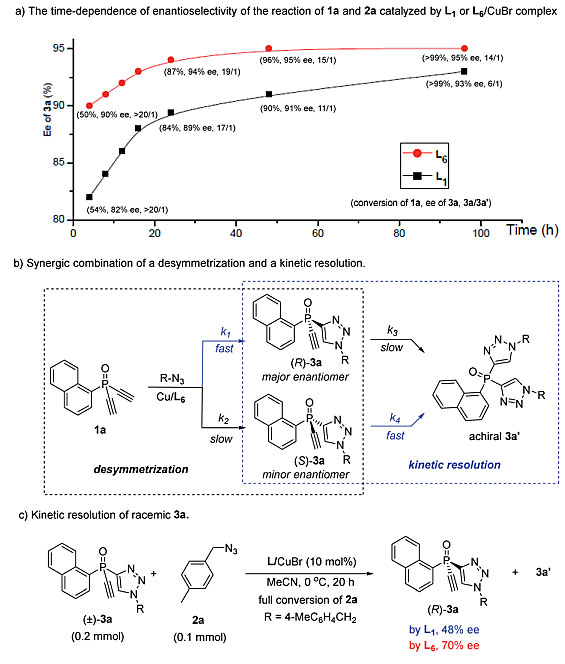
图3. 探究反应机理。图片来源:Chem. Sci.
在最佳反应条件下,作者考察了二炔基膦氧化物1a和叠氮化物2a的去对称化CuAAC反应的底物范围(图4)。二炔基膦氧化物的取代基对反应具有明显的影响。带有1-萘基或2-取代苯基的二炔基膦氧化物1a-d能够以较好的收率和对映选择性得到三唑3a-d。而带有3-MeO或3-溴苯基的二炔基膦氧化物1e-f则以较低的M/D比得到相应的产物3e-f。含4-叔丁基-苯基的膦氧化物1g以90%的ee 值和10:1的M/D比得到产物3g。然而,叔丁基取代的膦氧化物1h反应得到的产物3h的ee 值降低至75%,且只有3∶1的M/D比。各种脂肪族叠氮化物2b-h都能够兼容该反应,以良好的产率、优异的ee 值和高的M/D比得到产物3i-o。
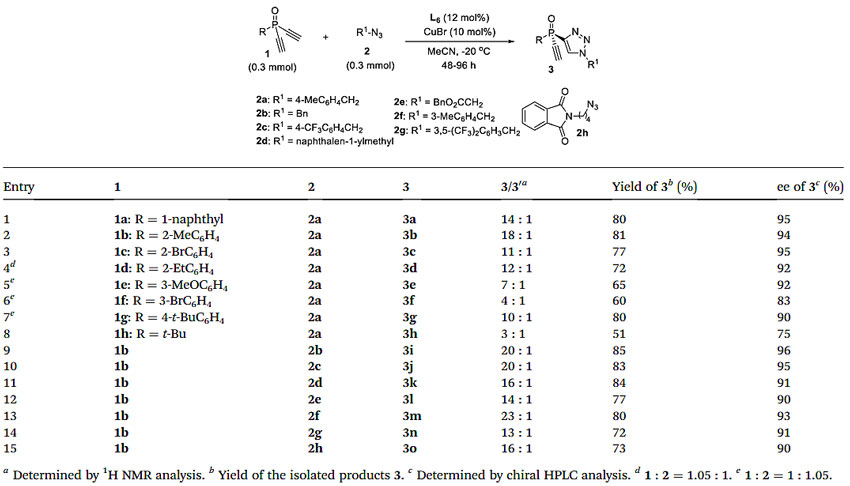
图4. 不对称CuAAC反应底物拓展。图片来源:Chem. Sci.
由于配体L6在外消旋单三氮唑3a的动力学拆分中能获得较好的结果,所以在相同的条件下,作者尝试了利用叠氮化物2a对炔基膦氧化物4a进行动力学拆分。令人高兴的是,当使用相对于4a 0.5当量的叠氮化物2a时,反应效果很好,单三唑5a的产率为44%,ee 值为85%,回收(S)-4a的ee 值为80%,收率为44%。
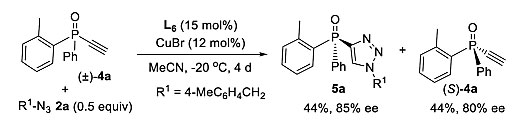
图5. 4a的动力学拆分。图片来源:Chem. Sci.
进一步的优化条件以L7为配体,以0.52当量的叠氮化物2a对炔基膦氧化物4进行了动力学拆分(图6)。无论R1上的取代基是苯基、2-噻吩基、环己基或异丙基,都能以85-99%的ee 值得到带有乙炔基的手性邻甲基苯基取代的膦氧化物4a-g。将2-甲基苯基改为2-溴苯基或1-萘基,相应的炔基膦氧化物 4h和4i的产率分别为44-45%,ee 值为95-97%。含有三唑基的外消旋乙炔基膦氧化物3a、3b,也可以很容易地拆分得到手性3a、3b,回收率和ee 值都良好。这些带有乙炔基的P-手性膦氧化物还能经过不同的多样化反应来提高结构的多样性。
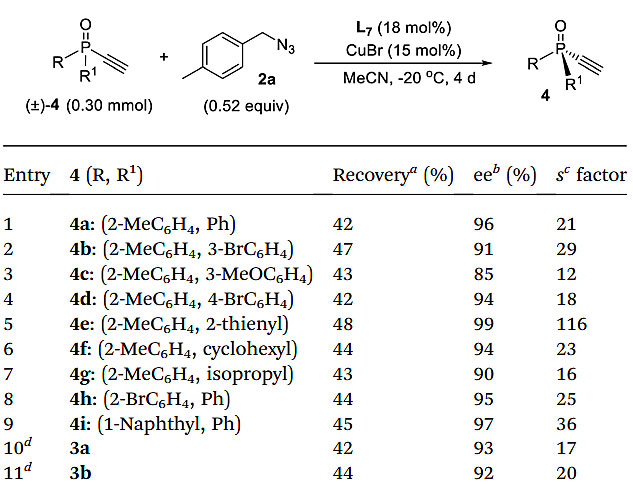
图6. 4的动力学拆分底物范围。图片来源:Chem. Sci.
另一方面,作者对炔基膦氧化物4高度对映选择性生成含有1,2,3-三氮唑的P-手性氧化膦5的反应条件进行了优化(图7)。通过使用配体L8,调节叠氮化合物2与炔基膦氧化物4的比例,可以耐受一系列不同的P-手性P-取代基,包括取代的苯基、2-噻吩基、1-萘基和脂肪基,得到含有1,2,3-三氮唑部分的P-手性膦氧化物。
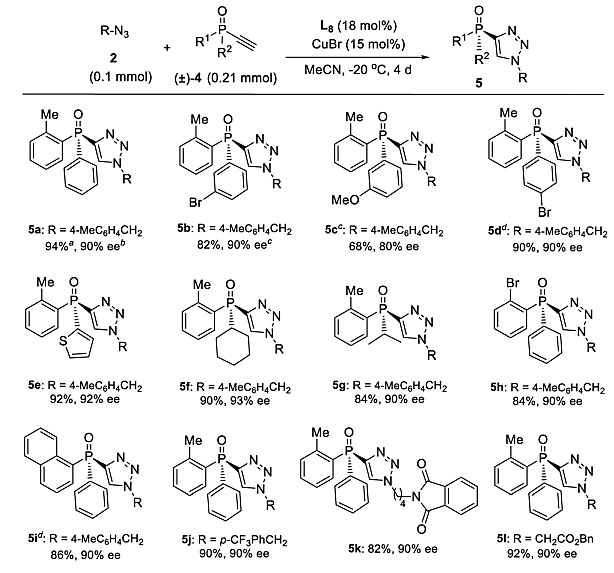
图7. 4和2的对映选择性CuAAC底物范围。图片来源:Chem. Sci.
在不对称催化中实现面的远程控制仍然颇具挑战。如果前手性中心离反应中心较远,由于手性偏差的减小,很难发展一种高对映选择性的远程去对称化反应。大多数方法都是基于底物,即前手性中心离反应中心最多间隔三个共价键(图8)。在间隔四个或四个以上共价键的远程分子间去对称化则是罕见的。由于PYBOX配体L6在抑制副反应和提高对映选择性方面优于L1,作者尝试改变这些配体的C4屏蔽基团的大小来发展膦氧化物-二炔6的去对称化CuAAC反应,该化合物中乙炔基距离P-中心间隔有四个共价键。值得一提的是,基于磷氧化物的共轭体系因其独特的电子特性而备受关注。对膦氧化物-二炔6的不对称CuAAC的研究,不仅可评价配体L5-L8在远程对映面控制中的性能,而且还可得到具有潜在用途的手性膦氧化物衍生物。优化结果表明,L5/CuBr能以98%的ee 值得到产物7a且7a/7a’比可达6.6:1(图8)。通过将6a和2h的比值从1.0:1调整为1.2:1,7a/7a’的比值跃升到12:1,而ee 值保持不变。
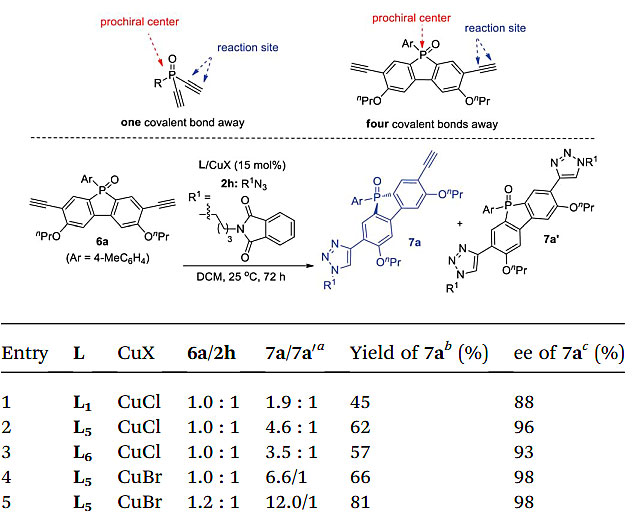
图8. 6a的对映选择性CuAAC底物范围。图片来源:Chem. Sci.
接着,作者考察了去对称化CuAAC反应的普适性(图9)。芳基和烷基P-取代基都可以兼容,以较好的收率和7a/7a’比得到目标产物7a-i。带有不同醚基团的底物均反应良好,得到产物7j-l。此外,各种叠氮化物也能够实现该转化,以较高的收率和7a/7a’比得到单三唑7m-t。值得注意的是,所有的手性膦7均具有> 90%的ee 值。
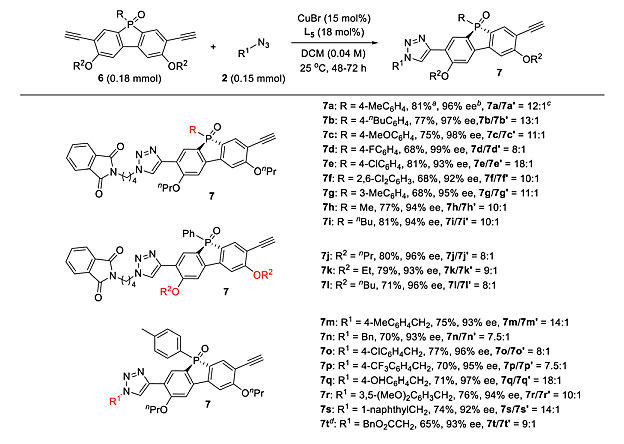
图9. 膦氧化物-二炔的CuAAC底物范围。图片来源:Chem. Sci.
由此得到的含有乙炔基的P-手性叔膦氧化物可用于P-手性膦衍生物的多样性合成(图10)。例如,以克级规模合成的产物3a,ee 值为95%,3a/3a’比为11:1。在Sonogashira反应后接着还原可将3a转化为叔膦9且ee 值保持不变。有趣的是,膦9还能与联烯酯10反应生成三唑基被取代的氧化膦11且ee 值保持不变。同样,从5a得到的叔膦12也进行了同样的取代反应,以89%的ee 值得到了产物13。根据膦14的绝对构型,可以看出在取代反应中,叔膦9或12的绝对构型发生了翻转。
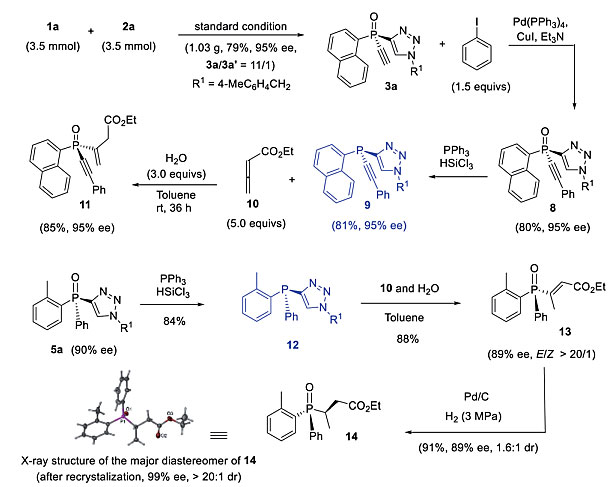
图10. 3a和5a的衍生化。图片来源:Chem. Sci.
P-手性单乙炔基膦氧化物4可用于开发新的P-手性有机催化剂(图11)。例如,通过两步转化可以很容易地得到P-手性膦16且其ee 值保持不变。起初,这些膦用于查尔酮和10的[3+2]环加成反应,生成的产物17a最高ee 值为84:16。这表明P-手性单乙炔基膦氧化物4具有开发P-手性配体或有机催化剂的潜力。值得注意的是,在苯环的邻位上有甲基或溴取代基,所得到的手性单膦可以很容易地通过衍生化来增加结构多样性。
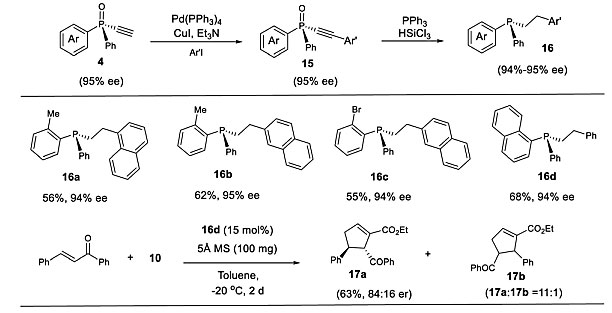
图11. 16的合成及应用。图片来源:Chem. Sci.
单乙炔基膦氧化物4作为P-手性合成砌块的多功能性,通过与手性亚胺18的非对映多样性Mannich反应进一步得到证明(图12)。由于(R)-和(S)-4a都可以很容易地通过上述的动力学拆分以优良的ee 值得到,因此,用(R)-或(S)-18进行烷基亚胺加成反应可以很容易地获得化合物19的四个异构体。由此得到的多功能P-手性膦氧化物19含有三个不同的手性中心,一个碳和两个杂原子手性中心,这是开发新的手性配体和有机催化剂的一个很有吸引力的骨架。
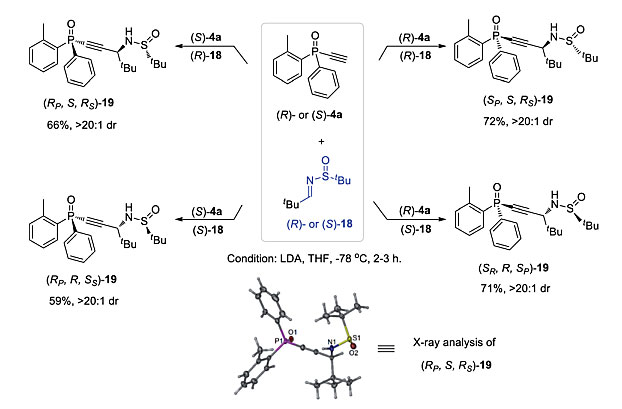
图12. 19的非对映多样性合成。图片来源:Chem. Sci.
此外,P-手性单乙炔基膦氧化物4可以经过Glaser偶联和还原,得到4-双(R)-二炔基膦基丁烷20,可用于形成双Au(I)-配合物(图13)。
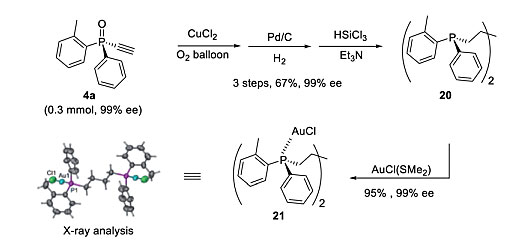
图13. 双Au(I)-配合物21的合成。图片来源:Chem. Sci.
光学活性的膦氧化物7也是光电研究的热点,它可以通过衍生化乙炔基团实现进一步官能团化(图14)。例如,从对映体7a可以很容易获得一种未报道过的基于膦氧化物的手性铂(II)乙炔化物22,这可能对有机金属凝胶、太阳能电池和发光材料领域的研究具有重要的意义。鉴于Pt-乙炔化物作为功能单元的重要性,从7a开始,经Sonogashira偶联得到扩展的π-体系化合物23,产率57%且ee 值保持不变。用Lawesson试剂处理23,得到手性P-硫化物24。随后作者考察了化合物6a、7a、23和24的光学性质,吸收和发射数据显示与6a相比,化合物7a的紫外/可见吸收峰和发射带极大值略有红移,而扩展π-体系产物23的紫外/可见吸收峰和发射带极大值明显红移。此外,7a的量子产率(QY)明显高于6a (0.40 vs. 0.14),而手性P-硫化物24的QY则低于23。这些结果表明手性膦7的特性可以很容易地得到调节从而实现其在光电领域的应用。
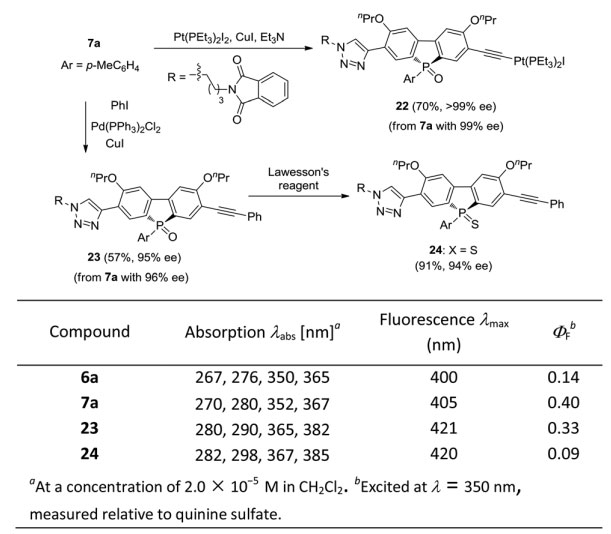
图14. 22-24的合成及其应用。图片来源:Chem. Sci.
总结
周剑教授课题组开发了高对映选择性CuAAC反应,用于合成多功能的含有乙炔基的P-手性膦合成子,它可以进行各种多样化的反应,以获得结构多样性的P-手性膦衍生物。重要的是,作者新开发的具有C4大位阻屏蔽基团的PYBOX型配体,为开发对映选择性CuAAC提供了解决方案。通过改变C4屏蔽基团,开发了以下三种应用:(1)二乙炔基膦氧化物1的去对称化,(2)单乙炔基膦氧化物4的动力学拆分,(3)对膦-二炔类7的远程去对称化;都能够以优良的对映选择性制备P-手性膦衍生物。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Enantioselective synthesis of P-chiral tertiary phosphine oxides with an ethynyl group via Cu(I)-catalyzed azide–alkyne cycloaddition
Ren-Yi Zhu, Long Chen, Xiao-Si Hu, Feng Zhou , Jian Zhou
Chem. Sci., 2019, DOI: 10.1039/c9sc04938j
导师介绍
周剑
https://www.x-mol.com/university/faculty/10524
关于Chemical Science:
英国皇家化学会综合性旗舰期刊,最新影响因子为9.556。发表化学领域最前沿、最重要、最具挑战性的高影响力研究成果。Chemical Science 是化学领域中影响力最大的开放获取期刊(open access),所有文章均可免费阅读。
 0
0










