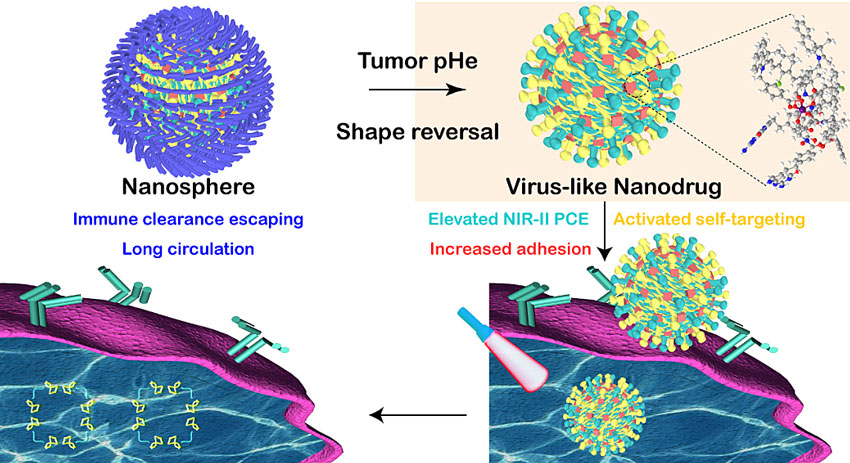
成像引导的光热-化疗联合治疗是肿瘤治疗的重要策略,但仍面临纳米药物在肿瘤部位和肿瘤细胞中缺乏有效的蓄积及光热转换效率不高等一系列问题。自然界中病毒因具有粗糙表面及刺突结构而易于黏附细胞膜,进而能够快速入侵细胞;受此现象启发,通过对病毒的尺寸(~100 nm)、微结构和表面拓扑形貌进行研究,采用仿生策略构建特殊粗糙表面的仿病毒纳米材料以增加细胞对其的吞噬和摄取效率以及光热转换效率。然而,纳米材料表面特殊形貌的直接暴露必然容易遭受免疫识别和巨噬细胞摄取,引发的机体快速清除,进而严重降低纳米材料的肿瘤组织递送效率。
针对肿瘤组织呈现的独特微酸性微环境,中国科学院海西研究院厦门稀土材料研究所转化医学中心的刘小龙研究员和刘景丰研究员团队将肿瘤微环境与纳米材料形貌转变相结合,选择NIR-I探针(IR825)、自靶向化疗药(培美曲塞)、镧系稀土金属离子(Nd(III))作为组装基元,基于金属配位驱动协同组装形成病毒状内核,继而在其周围引入肿瘤微酸响应性的PEG球形外壳,构建了“肿瘤微酸环境触发形貌反转致NIR-II光热转换效率提升、细胞膜黏附增强、主动靶向激活的病毒仿生光热-化疗一体化纳米探针”,实现了肿瘤微环境响应的高效靶向多模式协同治疗。该纳米探针可经长循环高效蓄积于肿瘤部位,而后经肿瘤微酸环境刺激触发其外壳分离实现形貌反转,由球形向病毒状快速转变,并重新暴露靶向化疗药,协同增强肿瘤细胞摄取;脱壳后的病毒状内核可展现出高光热性能和强光声信号,实现成像引导的NIR-II光热-化疗协同治疗。该工作为仿生型抗肿瘤靶向纳米药物的设计提供了新思路。相关工作已于近期发表在ACS Nano杂志。
李阳副研究员为该论文的第一作者,福建医科大学孟超肝胆医院蔺金燕博士后为共同第一作者。刘小龙研究员和刘景丰研究员为共同通讯作者。中国科学院福建物质结构研究所功能纳米结构设计与组装重点实验室为该论文第一署名单位。该研究工作得到了国家自然科学基金(81871483,81671813,U150522,61727823)和福建省孟超肝胆技术联合创新重点实验室开放性课题的资助。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Tumor Microenvironment Responsive Shape-Reversal Self-Targeting Virus-Inspired Nanodrug for Imaging-Guided Near-Infrared-II Photothermal Chemotherapy
Yang Li, Jinyan Lin, Peiyuan Wang, Qiang Luo, Huirong Lin, Yun Zhang, Zhenqing Hou, Jingfeng Liu, Xiaolong Liu
ACS Nano, 2019, 13, 12912-12928, DOI: 10.1021/acsnano.9b05425
 0
0