众所周知,亲核取代反应是有机合成中最基本的反应类型之一,主要有两种机理:单分子亲核取代反应(SN1)和双分子亲核取代反应(SN2,图1a)。SN1通过碳正离子中间体进行反应;而SN2则是亲核试剂从离去基团的背面进攻,亲核试剂的加成和离去基团的取代同时发生。这两种转化在有机合成、生物活性分子和天然产物的合成中具有广泛的应用。当使用双键作为亲核取代的中继时,与机理相关的SN1'和SN2'反应也得到了广泛的研究。由于环丙烷的反应性与C = C双键很相似,因此酸催化的环丙基甲醇的高烯丙基重排与乙烯基亲核取代反应具有相似性(图1b)。Honda课题组曾利用取代的环丙基甲硅烷基甲醇研究了高烯丙基重排的选择性(Tetrahedron Lett., 2005, 46, 6465-6468;Tetrahedron Lett., 2006, 47, 5751-5754)。另一方面,两亲性有机铝烷亲核试剂也可以通过非对映选择性1,6-加成反应促进烯基环丙基甲醇衍生物的选择性环断裂(相当于SN2'')(图1c)。应用该策略,从炔烃出发,仅需5步就能以25%的总收率合成botryococcene。
然而,尽管可以在非环状分子骨架中构建立体中心,但通过环丙基甲醇衍生物的直接分子间亲核取代来构建非环状分子骨架却未得到充分利用(图1d)。这可能是由于难以控制碳-碳键取代的反应性和选择性。1通过SN2'机理与亲核试剂应在C3位反应形成3,而在酸性和Brønsted酸条件下会形成碳正离子中间体,除了生成可能的加成产物2外,还可能促进副反应(如SN1产物、消除产物、异构化产物)。即使形成2,碳正离子中间体的存在也可能会导致四取代立体中心发生完全差向异构化(图1d)。
2019年,以色列理工学院的Ilan Marek教授(点击查看介绍)课题组报道了环丙基硅基甲醇的分子内Friedel-Crafts烷基化反应(图1e, Chem. Sci., 2019, 10, 9548-9554),即在烷基化程度最高的碳中心进行选择性断键并得到构型保持的产物。鉴于在四取代立体中心迁移的过程中未观察到差向异构化,于是,作者设想能否将亲核试剂加成到底物1上并在三元环上进行选择性亲核取代,而四取代立体中心的构型完全翻转。近日,他们实现了环丙基甲醇衍生物的季碳立体中心的区域选择性和立体选择性的亲核取代,并且得到构型完全翻转的产物。相关成果发表在J. Am. Chem. Soc. 上。
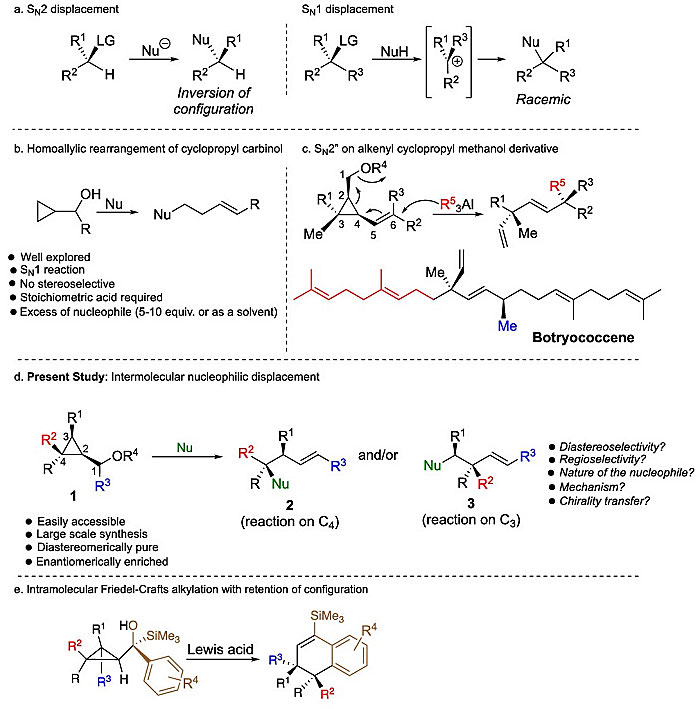
图1. 亲核取代。图片来源:J. Am. Chem. Soc.
作者选择1a作为模板底物、TMSBr作为亲核试剂,对反应条件进行了优化(图2)。反应24 h后,能够以优异的非对映选择性(dr > 95:5)得到2a,但产率中等并伴有消除产物4a。值得注意的是,在粗反应混合物中未检测到3a(C3位反应),这表明亲核取代仅发生在C4位(取代最多的碳中心)上。当向反应中添加催化剂PTSA•H2O时,能够以中等的收率得到2a,并且4a的量降低,但伴有另一种副产物叔醇5a的生成。于是,作者筛选了各种Lewis酸,都能以优异的非对映选择性(dr > 95:5)和较好的收率得到产物2a。鉴于CuBr2廉价易得且易于处理,最终将其选为催化剂。
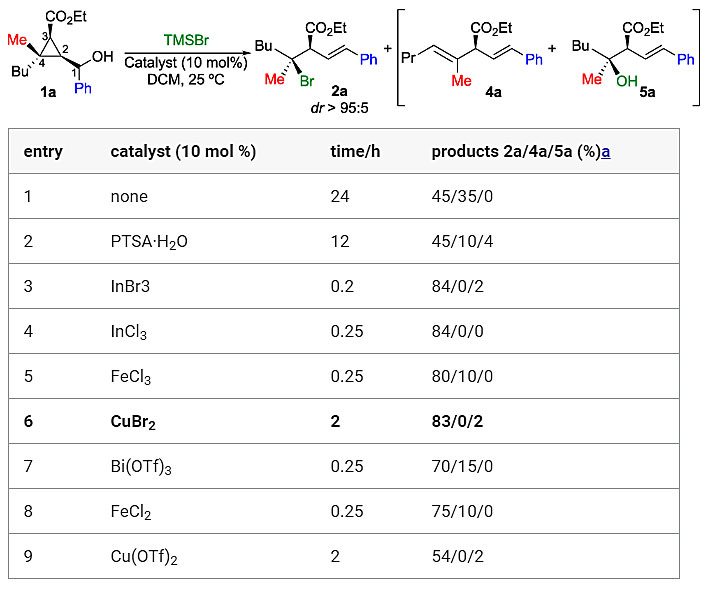
图2. 条件优化。图片来源:J. Am. Chem. Soc.
有了最佳反应条件,作者对反应底物的范围进行了考察(图3)。当使用TMSBr作为亲核试剂时,均能以优异的非对映选择性(dr 95:5)和较好的收率得到目标产物(2a-2e),证实了在1的亲核取代反应中立体化学完全转移。引人注意的是,双环丙烷1m经历了双开环反应,以优异的非对映选择性(dr 95:5)和较好的收率(68%)得到2e。当使用TMCSC1作为亲核试剂时,观察到相同的反应性,并且以优异的非对映选择性制备了叔烷基氯化物(2f-21),同时还能够以700 mg的规模制备2f。值得一提的是,1的选择性开环并不局限于R1 = CO2Et,也可以是醇、烯丙基、Me或亚甲基(2i-2l)。此外,所有底物的开环反应均在四取代立体中心进行,而不改变取代反应的选择性或非对映选择性。
尽管只有少量的含氟天然产物,但将氟元素引入有机分子中一直是药物设计中的一项重要工作。于是,作者尝试用氟化试剂对环丙基甲醇衍生物进行亲核取代。然而,由于TMSF昂贵且不易获得,通过一系列筛选,最终发现48% HBF4水溶液是最合适的氟化试剂。HBF4在水溶液中,反应混合物中始终会观察到20%左右的醇加成产物(Nu = OH),降低了烷基氟化物的产率。对于各种芳环取代(2m-p)以及脂肪醚(2r)取代的底物都能以优异的非对映选择性和中等的收率得到叔烷基氟化物。R3的性质可以改变,即使炔基上存在不稳定的SiMe3,烯炔也不会改变转化(2v、2w);酯也可以被烷基链取代,且不会影响三元环上亲核取代的选择性(2u)。此外,该反应是立体特异性的,因为只需简单地改变环丙基环上的两个取代基的性质(1a、1b),就能够制备含有季碳立体中心的两个非对映异构体(2m、2n)。最后,作者根据原料和产物的构型,证实了亲核取代发生在季碳立体中心,并且构型完全翻转。
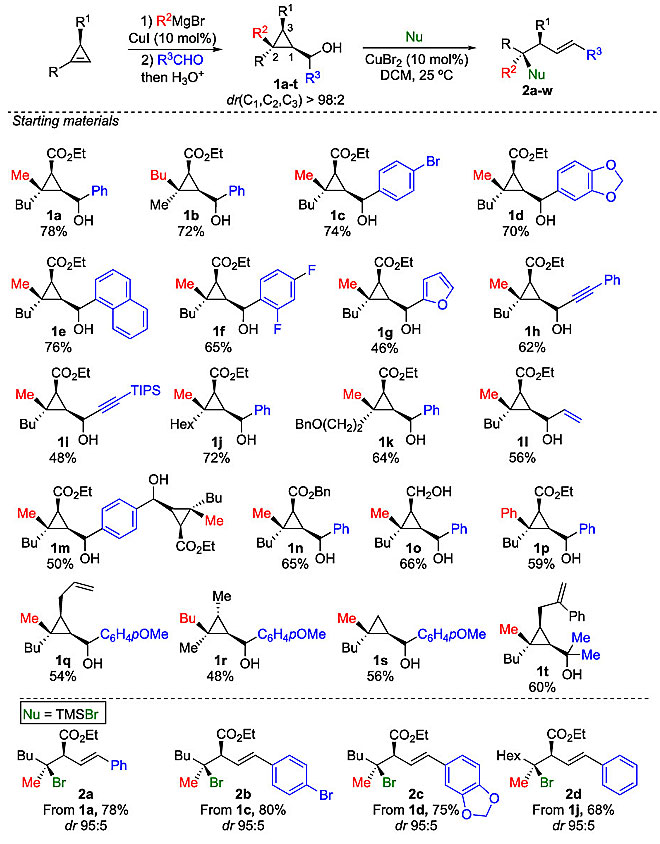
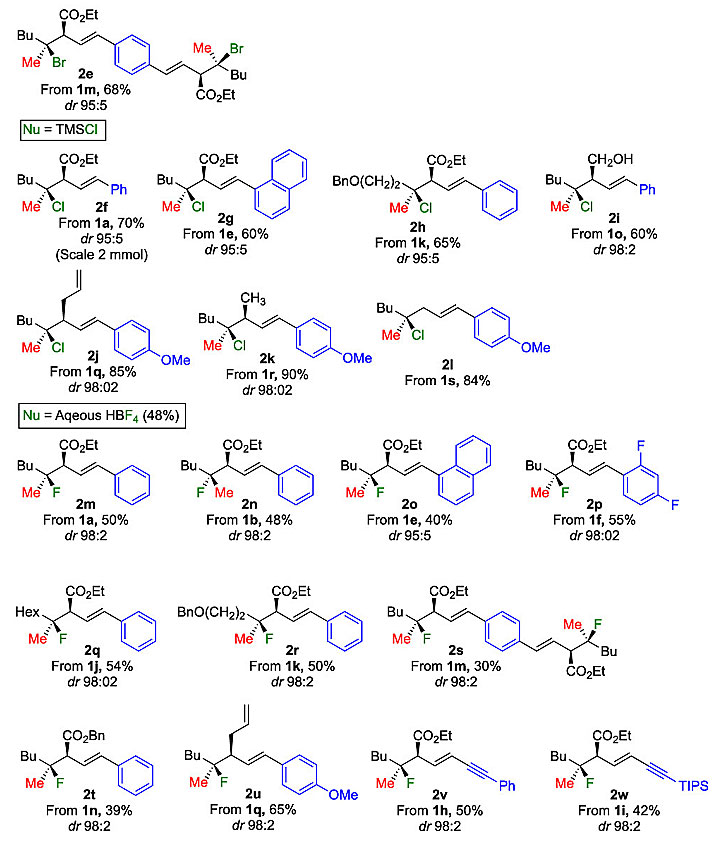
图3. 底物扩展。图片来源:J. Am. Chem. Soc.
为了进一步探索该反应的多功能性,作者选择三氟乙酸(TFA)作为亲核试剂,与环丙基甲醇衍生物反应以生成所需的羧酸酯偶联产物(图4)。尽管反应能够顺利进行,但用柱色谱纯化时产物会分解。因此,作者选择三氯乙酸(TCA)作为亲核试剂。各种环丙基甲醇衍生物1都能够以优异的非对映选择性和中等到良好的收率转化为叔酯(2x-2ag)。值得注意的是,R3也可以是杂芳基、乙烯基或甲基(2ab、2ac、2af),尽管2ab和2ac的收率较低。此外,从廉价易得的炔烃出发,仅需两步就能制备环丙基甲醇,因此利用环丙基甲醇的亲核取代反应就能轻松且高效地制备具有高非对映选择性和高对映选择性的叔烷基氟化物和叔烷基酯衍生物(图5)。
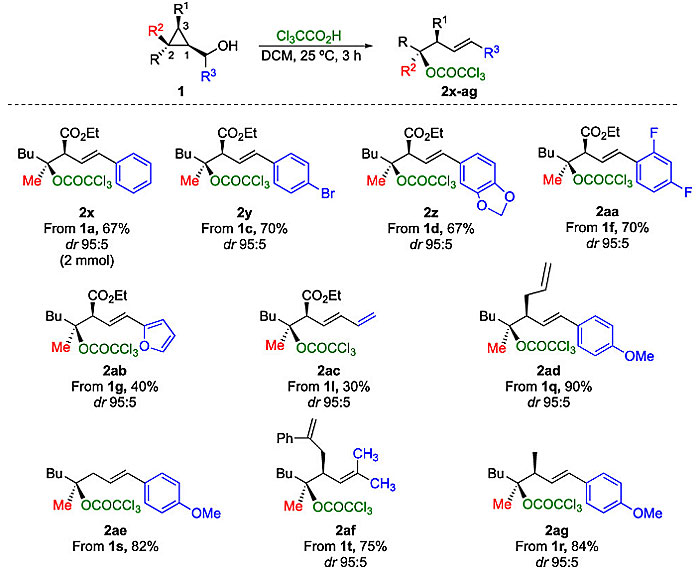
图4. 三氯乙酸对环丙醇的加成。图片来源:J. Am. Chem. Soc.
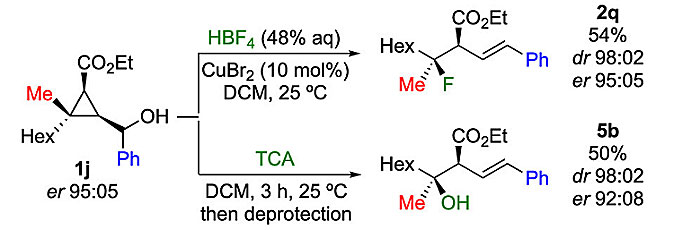
图5. 无环三级烷基氟及酯的制备。图片来源:J. Am. Chem. Soc.
为了合理地解释该反应的选择性(即在取代基最多的碳中心发生亲核取代),作者设计了如下反应(图6a),发现该反应与甲醇中心的立体化学无关,这表明该反应是通过形成环丙基碳正离子A进行的(图6b),最好以杂化形式B表示。由于过渡态的正电荷遍布于整个分子,因此亲核试剂从B中正电荷最稳定的位点(即取代基最多的碳中心)进攻,从而得到四取代立体中心构型翻转的高烯丙基产物2。另外,碳正离子中间体稳定性的细微变化不会影响反应的区域选择性,但会产生两种非对映异构体。例如,1u发生反应时会在C2位产生苄基碳正离子中间体,得到单一的区域异构体2ah,但为两个等量的非对映异构体(图6c)。
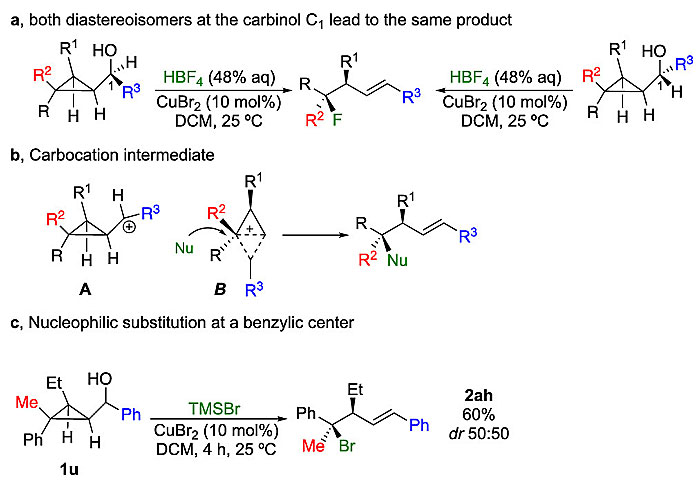
图6. 机理研究。图片来源:J. Am. Chem. Soc.
总结
Ilan Marek教授课题组实现了环丙基甲醇衍生物季碳立体中心的区域选择性和立体选择性的亲核取代,并且构型完全翻转,得到单一的非对映异构体。该反应的选择性归因于环丁鎓物种B的存在,在取代基最多的碳中心发生反应。该反应为叔烷基溴化物、氯化物、氟化物以及叔烷基酯的合成提供了一条简便高效的方法。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Nucleophilic Substitution at Quaternary Carbon Stereocenters
Veeranjaneyulu Lanke, Ilan Marek
J. Am. Chem. Soc., 2020, 142, 5543-5548, DOI: 10.1021/jacs.0c01133
导师介绍
Ilan Marek
https://www.x-mol.com/university/faculty/49798
 0
0












