英文原题:All-in-One Molecular AIE Theranostics: Fluorescence Image Guided and Mitochondria Targeted Chemo- and Photodynamic Cancer Cell Ablation
通讯作者:刘斌,新加坡国立大学
作者:Bing Guo (郭兵), Min Wu (吴敏), Qi Shi(施琪), Tianjiao Dai(戴天娇), Shidang Xu(许适当), Jianwen Jiang(姜建文), and Bin Liu (刘斌)
近年来肿瘤早期诊断与治疗手段有所进步,但是恶性肿瘤治疗仍是一个艰巨的挑战,在长期化疗中很多肿瘤病人会出现耐药性。为了提高肿瘤治疗疗效,多种治疗方法比如放疗、光动力治疗及其药物正在被研究和检验,这些方法和药物各自表现出不同的优势和劣势。因此,开发能够集合不同治疗方法优势的化学分子药物对临床肿瘤治疗具有重大意义。
光动力治疗能够时空可控,不易产生肿瘤耐药性,但是光动力治疗对乏氧肿瘤和深部肿瘤的治疗效果较低。化学药物能够克服光动力治疗的不足。鉴于此,新加坡国立大学刘斌教授(点击查看介绍)团队近期设计和制备了基于顺铂的多功能改性分子药物,实现了肿瘤线粒体靶向的联合光动力和化疗的诊疗一体化功能。该药物不仅能够选择性靶向肿瘤细胞,而且化疗疗效和顺铂相当。更重要的是,该药物联合光动力治疗后,总体疗效高于顺铂。
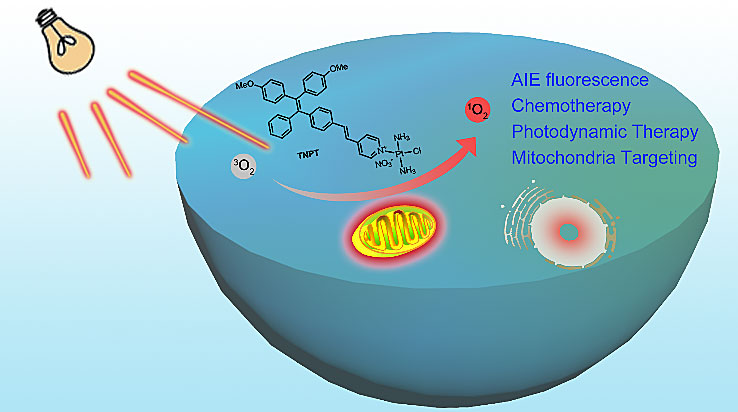
基于顺铂的多功能改性分子药物示意图
研究人员以聚集诱导发光染料(AIEgen)和顺铂分子为起始单元,进行配位偶联形成新的顺铂改性分子,如图1所示。研究人员选取两个不同电子给体功能的聚集诱导发光染料(TN和TM)为代表,研究不同聚集诱导发光染料给体结构对顺铂改性分子(TNPT和TMPT)性能的影响。新生成的分子由于电子给体-受体结构(D-A)增强,形成分子内电荷转移效应,红移吸收和发射波长。由于重金属Pt的作用,新生成的分子的ΔEST显著降低,有利于增强ROS。同时,由于顺铂的引入,新的分子不仅具有顺铂的化学治疗的功能,同时由于正电荷离子键的引入,使新的分子能够更有效的进入癌细胞线粒体中,从而显著提高肿瘤治疗疗效。

图1. (a)不同AIEgen-顺铂分子结构式; (b)TNPT 和 (c)TMPT 在不同水含量的四氢呋喃/水体系中的荧光光谱。
研究表明,TNPT和TMPT比其他分子(TN和TM)具有更好的肿瘤细胞靶向性,其原因是相比于正常细胞,肿瘤细胞的电负性更大,且其内吞外界物质的能力更活跃。同时,TNPT比其他分子具有更好的线粒体的靶向效果(图2)。通过分子模拟,研究人员发现相比于其他分子,TNPT独特的化学结构使其与水分子具有更强的亲和力,更容易分散在水中,进而有利于带正电荷的TNPT分子进入细胞线粒体中。
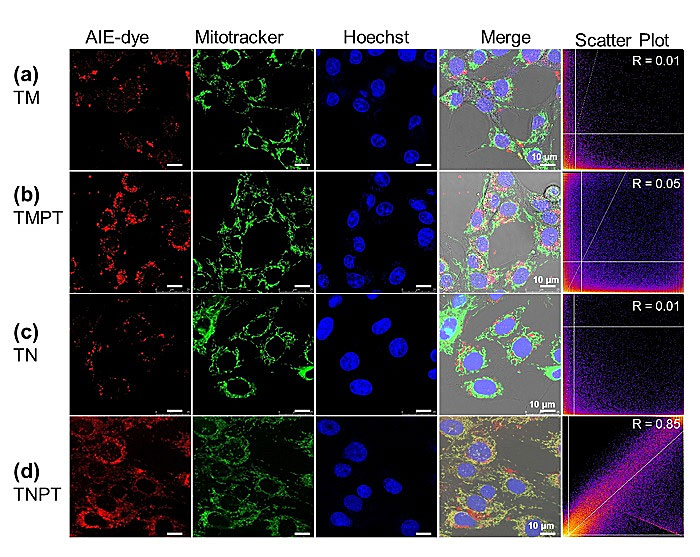
图2. 不同AIEgen-顺铂药物分子对线粒体靶向的结果
接下来,进一步研究了AIE-顺铂分子对肿瘤细胞毒性实验(图3),研究人员发现TNPT具有和顺铂类似的化疗效果,同时在光照下,TNPT对肿瘤细胞的杀伤能力显著提高。更重要的是TNPT比TMPT具有更好的活性氧产生能力,其原因是TMPT分子内电荷转移效果大,在非辐射跃迁方面过多消耗了激发态能量,降低了单线态和三线态能量的比例,进而降低了荧光强度和活性氧产生能力。同时,由于TMPT的疏水性比较大,不容易进入肿瘤细胞,导致其化疗效果比TNPT低。
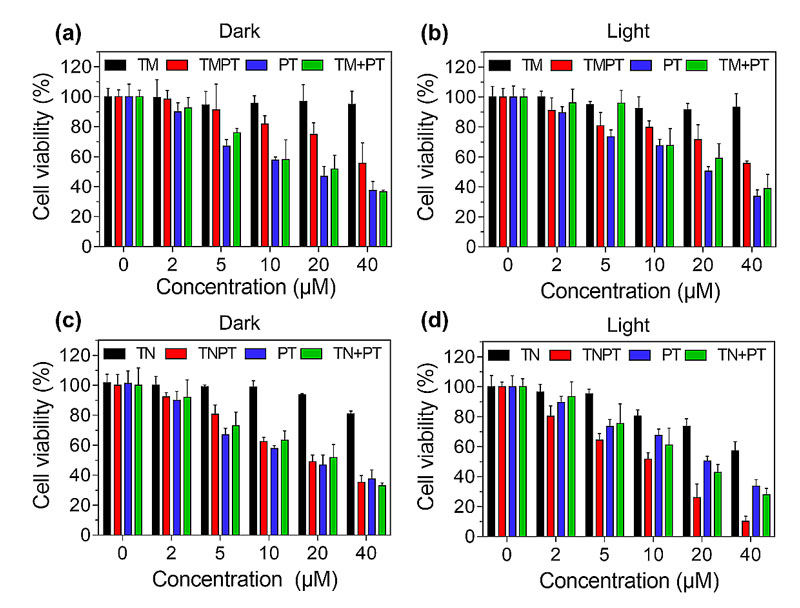
图3. 不同AIEgen-顺铂药物分子在黑暗条件和光照条件下对肿瘤细胞杀伤的效果
为了进一步探究设计的AIE-顺铂药物分子对肿瘤细胞的杀伤的机制,研究人员使用流式技术监控不同药物分子对于细胞凋亡和周期的影响(图4)。研究表明,相对于其他药物,TNPT在光照下不仅能够更显著促进肿瘤细胞的凋亡,而且能有效的抑制癌细胞G2-M有丝分裂过程。这是因为,光照产生的ROS能促进细胞凋亡,而且TNPT能够更有效的和线粒体DNA结合,抑制细胞呼吸,进而对细胞的有丝分裂和DNA复制产生抑制。这证明TNPT很好的实现了一个分子同时有效实现光动力治疗与化疗联合治疗。
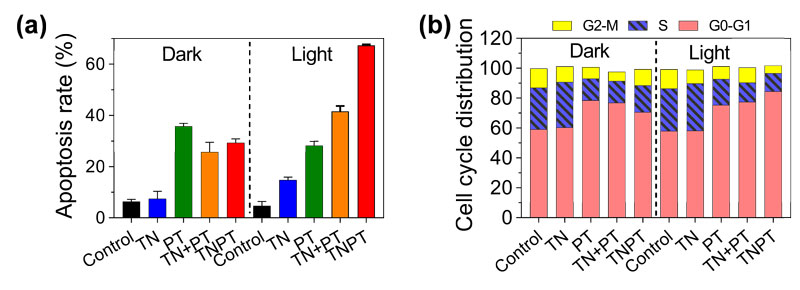
图4. 不同AIEgen-顺铂药物分子在黑暗条件和光照条件下对肿瘤细胞凋亡和周期的影响
该项目得到新加坡国家研究基金(R279-000-483-281、R279-000- 444-281)和新加坡国立大学研究基金(R279-000-482-133)的资助。
相关工作发表于Chemistry of Materials 上。新加坡国立大学郭兵和吴敏博士后为文章共同第一作者,刘斌教授为通讯作者。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

All-in-One Molecular AIE Theranostics: Fluorescence Image Guided and Mitochondria Targeted Chemo- and Photodynamic Cancer Cell Ablation
Bing Guo, Min Wu, Qi Shi, Tianjiao Dai, Shidang Xu, Jianwen Jiang, and Bin Liu
Chem. Mater., 2020, DOI: 10.1021/acs.chemmater.0c01187
Publication Date: May 11, 2020
Copyright © 2020 American Chemical Society
通讯作者简介

刘斌教授,新加坡国立大学教授,化学与生物分子工程学院系主任,新加坡工程院院士,亚太材料科学院院士,英国皇家化学会会士。同时也是ACS Materials Letters执行主编, Advanced Materials、Advanced Functional Materials等多个杂志的编委。致力于共轭聚合物发光材料、聚集诱导发光材料等在生物医学及能源中的应用研究,其成果多次发表在国际一流期刊,h-因子89,连续多年荣获科睿唯安“高被引科学家” 称号。其多项研究成果实现产业化并创立了LuminiCell公司。
https://www.x-mol.com/university/faculty/40437
(本稿件来自ACS Publications)
 0
0












