β-氨基酮是一类非常重要的合成砌块,在很多生物活性分子中,都能发现它的存在(图1a)。而作为Mannich反应中的一个分支,醛酮的胺甲基化反应可以非常高效的获得该类骨架结构。由于胺甲基片段的空间位阻较小、性质活泼,使得胺甲基化反应的对映选择性较难得到有效的控制,因此不对称胺甲基化反应吸引了众多研究者的关注。在已报道的少数不对称胺甲基化反应案例中,通过α-胺甲基醚、N,O-缩醛、1,3,5-三芳基-1,3,5-三嗪等胺甲基化试剂现场转化生成活泼的甲醛亚胺或甲醛亚胺盐,实现了对多种不同形式胺甲基化反应的对映选择性控制。
在这些已报道案例中,通常都是采用手性胺小分子催化剂或者金属Lewis酸与手性配体形成手性Lewis酸催化物种来活化醛酮底物,使得醛酮底物羰基α位的亲核性增加,能够对不稳定的甲醛亚胺及甲醛亚胺盐中间体实现有效的亲电加成,同时在亲核试剂一侧,实现对产物的对映选择性控制。这种基于亲核试剂活化的策略尽管非常有效,但却使得亲核试剂的底物范围被局限在醛、酮、1,3-二羰基化合物等羰基化合物中,使得胺甲基化反应的应用被大大限制。
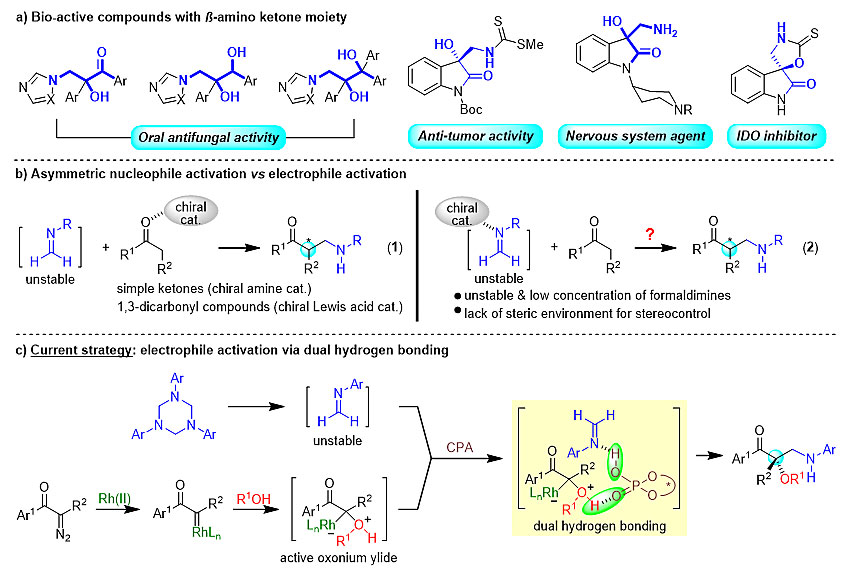
图1. 亲核试剂活化vs. 亲电试剂活化
近日,受到手性磷酸催化芳香醛亚胺Mannich反应的启发,在课题组围绕协同催化而开发的一系列不对称多组分催化转化的基础上,中山大学胡文浩教授与华东师范大学邢栋副教授联合研究团队实现了铑/手性磷酸协同催化基于亲电试剂活化的多组分胺甲基反应。通过手性磷酸对1,3,5-三芳基-1,3,5-三嗪现场分解生成的甲醛亚胺亲电物种进行活化,实现了对金属铑催化下形成的活性亲核性羟基叶利德中间体的不对称捕捉。该反应具有较广的底物范围,芳香醇、脂肪醇、复杂天然产物醇,甚至水都能兼容该反应,以良好的收率和对映选择性得到相应的产物。同时,运用该方法也可以实现抗艾滋药物达芦那韦(Darunavir)与胆固醇之间的对接,展现出了该方法作为药物对接工具反应的良好前景。
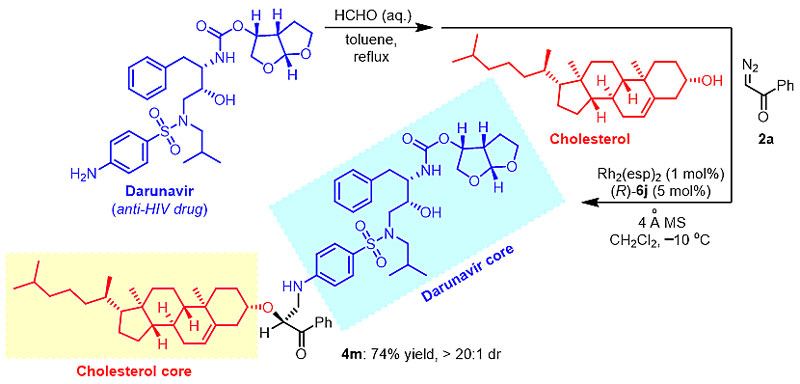
图2. 药物对接
相关结果发表在Nature Communications 上,华东师范大学大学博士研究生车久威为文章的第一作者。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Enantioselective three-component aminomethylation of α-diazo ketones with alcohols and 1,3,5-triazines
Jiuwei Che, Li Niu, Shikun Jia, Dong Xing, Wenhao Hu
Nat. Commun., 2020, 11, 1511, DOI: 10.1038/s41467-020-15345-2
导师介绍
胡文浩
https://www.x-mol.com/university/faculty/49984
 0
0












