转移是癌症患者致死的主要原因。由于实体肿瘤处于乏氧的微环境,不仅会导致肿瘤部位新生血管的生成以及乏氧诱导因子的形成,而且会降低肿瘤对化疗以及放疗的敏感性,从而诱发肿瘤的复发、侵袭和转移,成为肿瘤难以治愈的一个非常重要的原因。近日,武汉大学的张先正(点击查看介绍)团队设计了一种苯并卟啉基金属有机框架材料(TBP-MOF)用于高效的光动力学治疗,并结合PD-1/PD-L1免疫检查点屏蔽有效地抑制了肿瘤的转移和复发。
作为一种新型的临床肿瘤治疗的方式,光动力学治疗通过活性氧介导的机制发挥作用,即光敏剂在特定波长光照激发下将能量传递给周围的氧气分子,产生具有细胞毒性的单线态氧并杀死肿瘤细胞,该耗氧过程对肿瘤组织中的氧分压具有很强的依赖性。因此,对氧气的依赖性也严重影响光动力学治疗对乏氧肿瘤组织的疗效。光动力学治疗能够通过释放炎症媒介和细胞因子到肿瘤微环境来激活适应性免疫响应。这种抗肿瘤免疫响应能够进一步增强来调控T细胞。然而,肿瘤细胞本身可通过程序死亡受体(PD-1)/程序死亡配体(PD-L1)诱导T细胞凋亡以达到免疫逃逸。
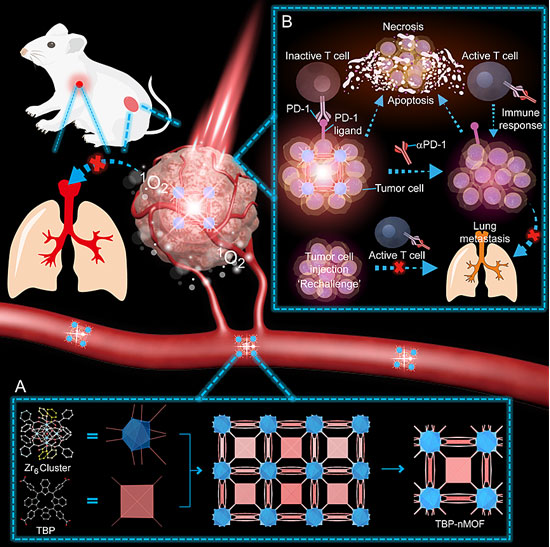
基于此,张先正团队利用高效的光动力学治疗激活免疫系统来对抗肿瘤,成功地设计了一种具有10连接Zr6金属簇的TBP-MOF,与传统的卟啉基MOF相比,它具有增强的光物理化学性质。同时,TBP-MOF也展现出红移的吸收带以及近红外的荧光发射,相比于传统的卟啉光敏剂,更有利于生物成像。同时,这种π共轭延伸的苯并卟啉基配体也展现了高效的单线态氧产生能力,有利于增强低氧环境下的光动力学治疗效果。此外,为了提高TBP-MOF的生物相容性以及EPR效应,他们在纳米TBP-MOF表面修饰了聚乙二醇(TBP-nMOF),并研究了肿瘤乏氧条件下的光动力学治疗效果。该团队还进一步将TBP-nMOF这种低氧气依赖的光动力学治疗与αPD-1免疫检查点治疗相结合,用于抑制原位瘤的生长以及激活抗肿瘤免疫响应,成功实现了对转移瘤生长的抑制。
这一成果近期发表在ACS Nano 上,文章的第一作者是武汉大学的博士研究生曾锦跃和邹梅珍。
该论文作者为:Jin-Yue Zeng, Mei-Zhen Zou, Mingkang Zhang, Xiao-Shuang Wang, Xuan Zeng, Hengjiang Cong and Xian-Zheng Zhang
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

π-Extended Benzoporphyrin-Based Metal-Organic Framework for Inhibition of Tumor Metastasis
ACS Nano, 2018, DOI: 10.1021/acsnano.8b01186
导师介绍
张先正
http://www.x-mol.com/university/faculty/13628
 0
0










