副标题:单电子还原实现钴催化烯酰胺的不对称氢化反应
谈起不对称氢化反应,人们总会想到2001年诺贝尔奖授予在催化不对称氢化领域做出卓越贡献的科学家Noyori和Knowles,他们的获奖不仅仅是因为在不对称催化领域的开创性研究,更重要的是其研究工作在工业中、特别是手性药物合成中的成功应用,以及更为广泛地带动该领域的学术研究和工业应用。自上世纪70年代Knowles首次使用不对称氢化的方法实现手性药物L-多巴的工业合成以来,该研究领域取得了空前发展,并在工业化应用中占据了举足轻重的地位。据统计,截止到2008年,适用于工业化应用(工业生产、中试、实验规模)的9类不对称催化反应中,有6类与不对称催化氢化反应相关,并且这6类催化反应的总数也远远超过其他类型催化反应的数量。[1] 目前,工业中的不对称氢化反应主要采用贵金属均相催化剂,如铑、钌、铱等,除了存在地壳中含量稀少、价格昂贵、毒性大、金属残留等问题之外,提取这些贵金属也会为环境带来负担,一定程度上限制了其在工业上的广泛应用。为了让催化过程的性价比更高并适应可持续发展的需求,化学家们绞尽脑汁希望利用地壳中含量丰富、生物兼容性好的铁、钴、镍来代替它们,然而真正高效、有潜力实现工业化的不对称催化氢化方法却很少。
最近,普林斯顿大学的Paul J. Chirik教授和美国默克研究实验室的Michael Shevlin博士等人合作,开创了一种钴催化烯烃不对称氢化反应的全新途径,该方法分别以绿色清洁的H2、MeOH为还原剂和溶剂,使用Zn粉作为活化试剂,在温和的加热条件下通过单电子转移机制将前体Co(II)催化剂现场还原为氢化活性更高的Co(I)催化剂,相应的Zn/手性配体/Co(II)催化体系在烯酰胺底物的不对称氢化反应中展现出优异的反应活性和对映选择性。在高通量自动化反应筛选技术的帮助下,他们发现Zn/(R,R)-Ph-BPE/CoCl2•6H2O催化体系可在催化剂用量S/C>1000的条件下,以高达97%收率、98%对映选择性实现200克规模抗癫痫药物左乙拉西坦(levetiracetam,Keppra)的不对称氢化合成。这是迄今为止非贵金属催化烯烃不对称氢化最为先进、廉价的合成技术之一,相关成果发表在Science 上。

图1. 钴催化Levetiracetam的不对称合成。
2013年,Paul J. Chirik和Michael Shevlin团队通过高通量反应筛选技术发展了一种高对映选择性双齿膦配体鳌合的Co(II)催化剂,可用于氢化官能化的烯酰胺底物。反应中使用硅烷基锂试剂活化双膦配体(P-P)螯合的CoCl2,通过交换氯离子形成高反应活性的双齿膦鳌合的Co(II)双硅烷基配合物(P-P)Co(CH2SiMe3)2,该催化剂发生氢解作用释放SiMe4,并生成二氢金属物种(P-P)CoH2,随后发生对烯烃的不对称加成。虽然该反应中催化剂的转换数(TON)较低,并不具备工业价值,但是该研究是不对称氢化反应发展史的一个里程碑,激发了人们探索廉价金属催化不对称氢化技术的浓厚兴趣。

图2. 硅烷基锂活化的钴催化不对称氢化反应。图片来源:Science
毫无疑问,要想把上述催化技术引入工业生产的一个主要挑战是提高催化剂的周转数以及确定抑制和毒化催化剂的原因。其中一个不容忽视的因素是,硅烷基锂不仅价格昂贵,且反应活性过高,容易导致手性Co催化剂的配体发生不可逆的解离,并生成无配体的惰性零价Co,从而失去活性。因此,为了实现工业化,不使用硅烷基锂活化试剂而得到双齿膦螯合的二氢金属物种(P-P)CoH2十分重要。为了达到这个目的,作者设想使用温和的还原剂首先将双膦配体螯合的Co(II) (P-P)CoCl2还原为配位的零价钴(P-P)Co,随后与H2发生氧化加成生成二氢钴物种(P-P)CoH2。基于此,作者选择具有烯酰胺结构的抗癫痫药物左乙拉西坦(levetiracetam,Keppra)的不对称氢化过程为研究对象,开启了这项极具挑战和重要意义的工作。
受益于美国默克的高通量自动化反应技术,他们首先以(R,R)-iPr-DuPhos作为手性配体,对二氢-左乙拉西坦的不对称氢化反应中钴催化剂、溶剂、活化剂及温度进行了大量筛选,结果表明,廉价易得且温和的还原剂如Zn、Mg、Mn、Fe粉等能在MeOH-THF混合溶剂中原位活化大多数的DuPhos/Co(II)X2络合物,在优化的条件下,反应在大多数金属还原剂-MeOH/THF体系中都能获得优秀的产率及对映选择性。接下来,作者在CoCl2/Zn/MeOH-THF体系下对反应的配体进行了考察,与以往的CoCl2/LiCH2SiMe3/THF体系相比,Zn活化的模式不仅能兼容更多类型的配体包括双膦配体、膦-氮配体、膦-硫配体等(图3A),还适用于其他类型的烯酰胺类底物,尤其是在代表性氢化底物2-乙酰氨基丙烯酸酸甲酯的氢化反应中,几乎所有尝试的192个手性配体都能顺利高效地实现相应的转化(图3B)。值得一提的是,当手性配体为(R,R)-Ph-BPE和(R,R)-iPr-DuPhos时,仅在0.2 mol%负载量的[Co]催化剂条件下,二氢-左乙拉西坦的不对称氢化反应即可获得优异的收率和对映选择性(图3C)。
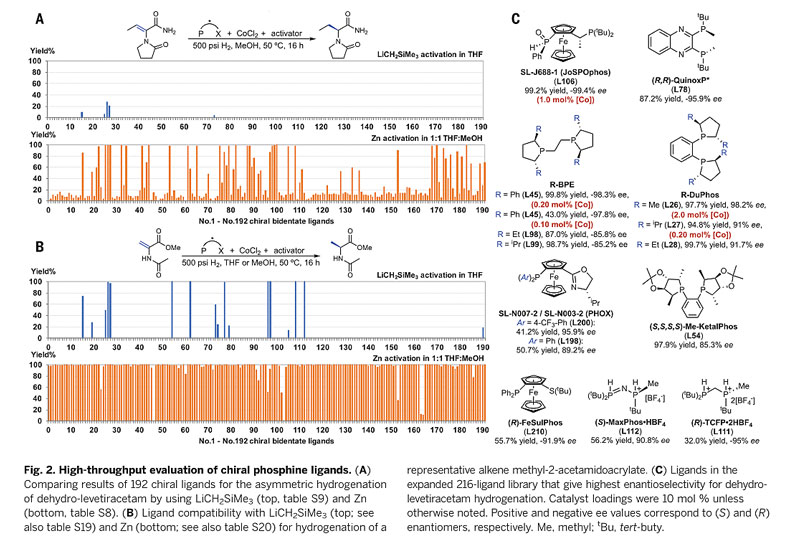
图3. 高通量自动筛选Zn活化钴催化的不对称氢化反应。图片来源:Science
为了更深入地研究影响金属催化剂活性的关键因素,作者设计了化学计量金属参与的反应实验。将(R,R)-Ph-BPECoCl2(2a)或(R,R)-iPr-DuPhoCoCl2(2b)加入MeOH中,他们意外地发现Co(II)的膦配体完全或部分解离,并生成了溶剂配位的[Co(MeOH)6][Cl]2,蒸发MeOH并加入THF后,该物种又重新转化为膦配体螯合的2a或2b,表明MeOH促进Co(II)手性配体的解离可能是导致催化剂失活的一个重要因素。那么Zn又是如何解决这一问题的呢?随后的研究发现,他们向含有(R,R)-Ph-BPE、(R,R)-iPr-DuPho和CoCl2•6H2O的THF-MeOH溶液中加入过量的Zn,分离出具有μ-氯桥键的Co(I)络合物3a和3b,同时,在Zn的还原作用下,体系中加入配体后[Co(MeOH)6][Cl]2也可生成3a和3b。他们发现在室温下的MeOH-THF混合溶剂中,Zn将2a完全还原为3a只需15 min,而仅用THF作为单一溶剂时这一过程则需要12 h才能完成,表明Zn-MeOH可通过加速氯化钴二聚体的生成抑制MeOH导致的金属-配体解离。此外,加入1,5-环辛二烯(COD),3a和3b可在Zn的还原下进一步生成膦配体螯合的Co(0)配合物4a和4b,表明Co(I)和Co(0)的生成经历了单电子还原的途径。他们发现无需使用Zn,二聚的Co(I)Cl-3a和Co(0)-4a在0.5 mol%的负载量下即可高效实现二氢-左乙拉西坦的不对称氢化反应。4a中的COD配体容易发生氢解,可快速生成二氢钴物种(R,R)-Ph-BPECoH2,而3a在烯酰胺的作用下先生成Co(II)Cl2-2a以及与底物配位的Co(0),后者进一步在H2的作用下生成二氢钴物种。氘代实验表明,二氢钴物种的生成通过双氢均裂途径进行,而非异裂。
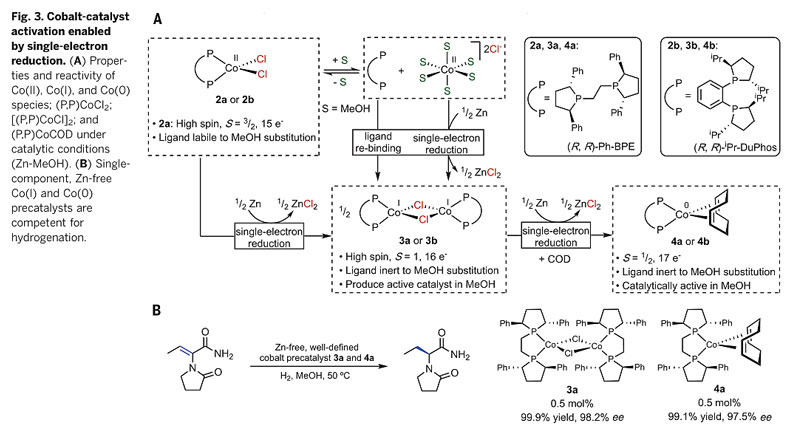
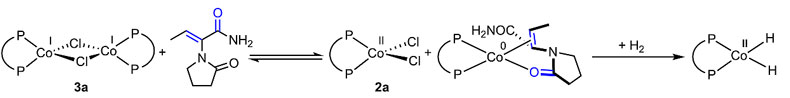
图4. 钴催化氢化反应的单电子还原机制。图片来源:Science
为了展示该方法在工业应用上的潜力,作者对该反应的合成工序进行了初步优化,最终能以0.08 mol%的催化剂负载量,200克量级规模下不对称合成抗癫痫药物左乙拉西坦,产率高达97%,ee值高达98.2%。值得一提的是,此前专利中通过不对称氢化合成该药物最高效的方法需要使用0.5 mol%的[Rh]催化剂(图5)。

图5. 200克量级规模Levetiracetam的不对称合成。图片来源:Science
——小结——
Paul J. Chirik与Michael Shevlin等研究者利用单电子化学克服了钴催化不对称氢化反应中的催化剂失活问题,激励人们思考如何使用这一化学过程去开发更丰富、廉价的第一行过渡金属(如铁、钴、镍等)催化剂。通过Zn活化模式结合高通量反应筛选技术,他们确定了可用于烯酰胺不对称氢化反应的钴-膦配体组合,并高效实现了200克量级规模抗癫痫药物左乙拉西坦的不对称合成。该方法提供了一种快速寻找廉价金属催化剂、配体、活化试剂最佳组合的途径,且几乎适用于所有的底物。这种不对称氢化反应无论在实验室合成还是工业生产中都体现出重要的价值,相信在不远的将来会实现廉价金属取代贵金属立足于不对称氢化工业生产的舞台。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Cobalt-catalyzed asymmetric hydrogenation of enamides enabled by single-electron reduction
Science, 2018, 360, 888, DOI: 10.1126/science.aar6117
导师介绍
Paul J. Chirik
http://www.x-mol.com/university/faculty/650
参考内容:
1.BÖrner A. Phosphorus ligands in asymmetric catalysis [M]. Weinheim: Wiley-VCH, 2008.
 0
0