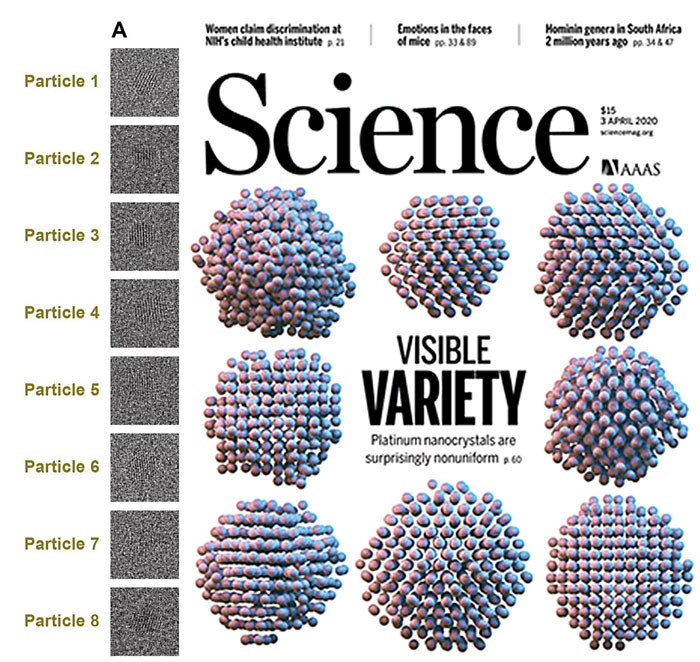
具有轴手性的芳香化合物结构广泛存在于天然产物、药物分子、催化剂和功能分子中。这类分子的合成方法通常是基于反应底物中已存在的芳香基团进行不对称的取代或修饰,从而构建出手性轴。但在多取代芳环结构中,逐步取代的方法往往会受到许多区域选择性的限制从而需要较长的合成步骤。而且当手性轴两边空间位阻类似的时候,不对称取代的方法往往很难能得到高的立体选择性。而另一方面,通过直接构建苯环来制备轴手性化合物的方法则有独特的优势。但不对称苯环构建的方法研究较少,主要集中在有机金属催化的三炔环化反应,在有机小分子催化反应中几乎未有报道。
最近,中山大学朱庭顺教授(点击查看介绍)课题组通过氮杂环卡宾(NHC)有机小分子催化的环加成串联反应,实现了一种高效、高选择性的轴手性苯环构建方法。反应以结构简单的共轭二烯醛和α-苯基酮为原料,一步构建了1,2,3,5-四取代苯环,同时在2-位形成轴手性(图1)。
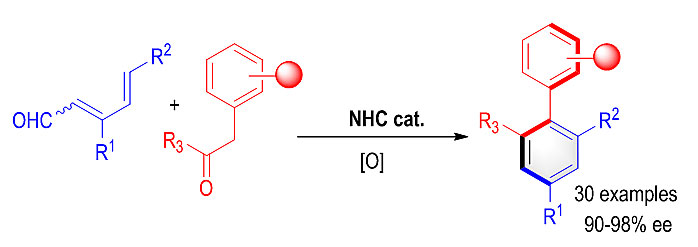
图1. NHC催化[4+2]环加成反应
该串联反应的反应机理如图2所示,NHC催化剂与不饱和醛在氧化的条件下形成acyl azolium中间体Ⅰ。由于催化剂的手性臂的位阻影响,酮底物与该中间体的1,6加成从re面进行,接着发生分子内aldol缩合反应得到六元环中间体Ⅲ,再经过内酯化反应得到中间体Ⅳ同时实现催化剂循环。中间体Ⅳ会在热力学推动下通过脱羧与氧化实现六元环的芳构化,同时完成了从中心手性向轴手性的转化。
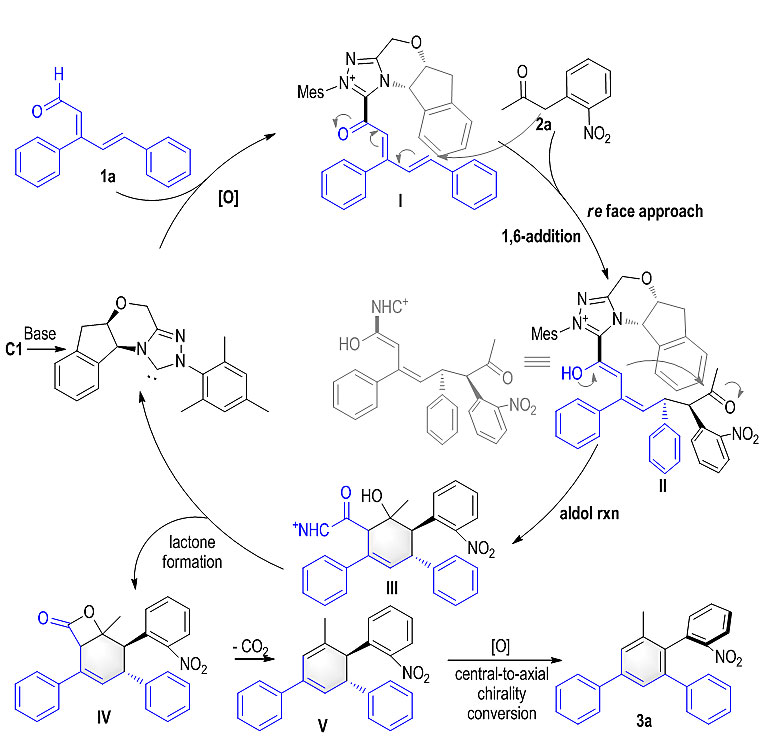
图2. 反应机理
该反应的底物适应性较好,其中对反应影响最大的是酮底物的α-H酸性,连接吸电子基团能明显提高反应产率。卤素、杂环、氰基、三氟甲基、磷氧化合物等都能在体系中耐受,给出较好的产率与90%以上的ee值(图3)。
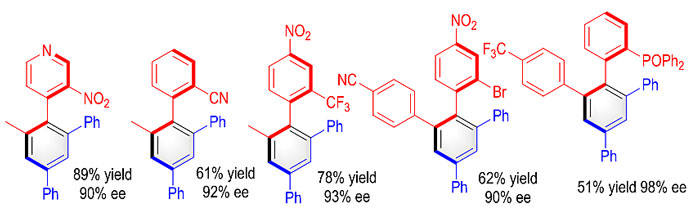
图3. 底物适用性示例
产物通过简单的转化,可以高效合成带有轴手性的各类催化剂与配体(图4)。
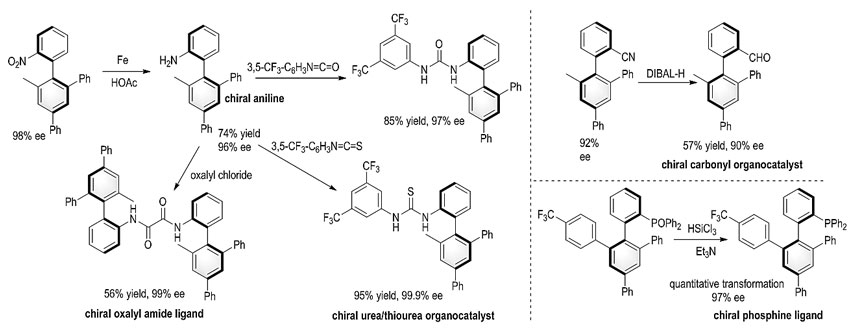
图4. 产物衍生化及应用
该反应还能与电化学反应体系兼容,通过氧化剂的电极循环,可以将原来2.5-3.5当量的氧化剂减少至催化量。
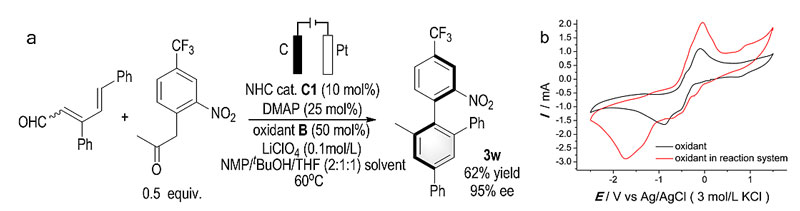
图5. 电化学体系的尝试
该工作拓展了NHC有机小分子催化合成方法学,为轴手性化合物的合成提供了一种具有潜力的合成手段。
相关工作发表在Angew. Chem. Int. Ed. 上。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Atroposelective arene formation via carbene-catalyzed formal [4+2] cycloaddition
Ke Xu, Wenchang Li, Shaoheng Zhu, Tingshun Zhu
Angew. Chem. Int. Ed., 2019, DOI: 10.1002/anie.201910049
导师介绍
朱庭顺
https://www.x-mol.com/university/faculty/64905
(本稿件来自Wiley)
 0
0