
图片来源:周星驰电影《少林足球》
#星爷镇楼#
看到“Dream reaction”,你想到的是什么反应?
本文要介绍的“Dream reaction”是醇的直接亲核取代反应。
亲核取代反应作为基础有机中重点学习的一类反应,在构建碳-杂原子键和碳-碳键中扮演着重要角色。醇是亲核取代反应中的最常见的亲电试剂之一,因为它们往往廉价且易于获得。对于醇的亲核取代反应,在理想情况下,应该是如图1a所示,副产物只有水。然而,事实上,由于羟基并不是一个好的离去基团,这类反应中往往还需要额外的试剂进行活化。其中,比较知名的是Mitsunobu反应,由日本科学家Mitsunobu Oyo与合作者于1967年首次报道。在经典的Mitsunobu反应中,需要加入等当量(或稍过量)的偶氮二甲酸酯与三苯基膦,二者分别作为氧化剂和还原剂,各自“吸收掉”反应的副产物水分子的氢和氧,拉动反应向右进行(简要机理见图1)。尽管与原子经济性原则相悖,Mitsunobu反应在醇的立体专一性翻转方面的优势,而广泛应用。催化反应在有机合成中的重要地位,使得直接催化取代反应方法学的发展,势必会取代这些非高效的现有方法。
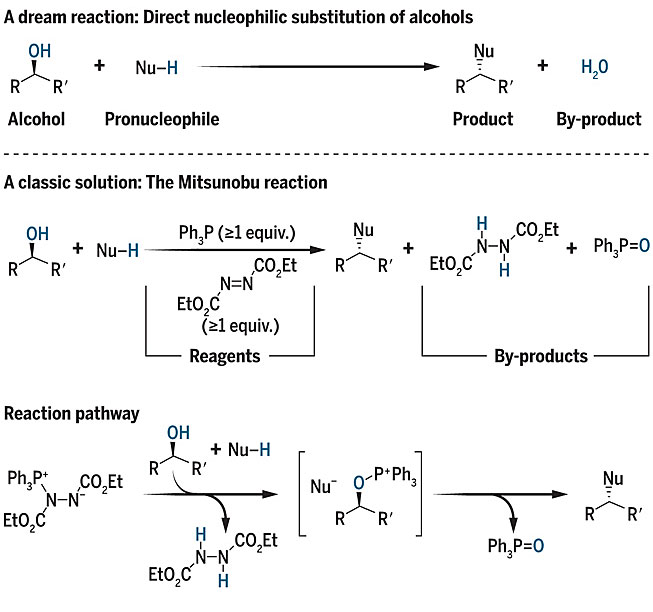
图1. 经典的Mitsunobu反应实现了醇的亲核取代反应,但原子效率不高。图片来源:Science
从转化率看,Mitsunobu反应是一个优秀的反应,并且在反应中手性结构的醇表现出构象反转。但反应转化率高并不能让它满足绿色化学的时代潮流,因为额外加入的两个等当量的活化剂严重拉低了反应的原子效率,同时产生的肼衍生物具有较大毒性。在过去的半个多世纪中,科学家们一直希望能改善这点,实现醇的直接亲核取代反应,但进展有限。其中比较重要的工作之一是,2007年香港大学的Patrick H. Toy等在体系中额外的添加二乙酰基碘化苯作为氧化剂,使得Mitsunobu反应中的毒性副产物肼衍生物能够再生得到偶氮二甲酸酯,从而将偶氮二甲酸酯的用量可以是催化量而不是等当量,同时反应需要2当量的三苯基氧膦(J. Am. Chem. Soc., 2006, 128, 9636)。而进一步,Taniguchi和Košmrlj及其团队在2013年和2016年分别报道了更高效率的再循环方案,通过铁酞菁为共催化剂,用修饰的芳基偶氮甲酸酯可以巧妙用氧气氧化再生。该方案成功地使Mitsunobu反应对氧化剂实现了催化循环,但当量的膦还是需要的。进一步的研究仍然建立在当量氧化剂和还原剂的再循环,这无法突破原子经济性的水平上线。
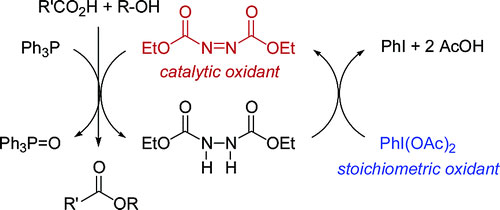
图2. 添加氧化剂使得Mitsunobu反应产生的有毒副产物肼衍生物能够再生。图片来源:J. Am. Chem. Soc.
直到近期,英国诺丁汉大学Rhydian H. Beddoe(第一作者)和Ross M. Denton(通讯作者)等研究者设计合成了一个有机催化剂:氧化膦化合物1(图3),它能以催化剂的方式参与醇的亲核取代反应,其结果是整个反应产生的副产物只有水分子,相关结果发表在Science上。作者思考催化的Mitsunobu反应,需要可实现非常规转化的催化剂,使得能够从五价膦催化物种生成Mitsunobu活性膦物种,整个过程中,催化剂中的P价态没有发生改变。
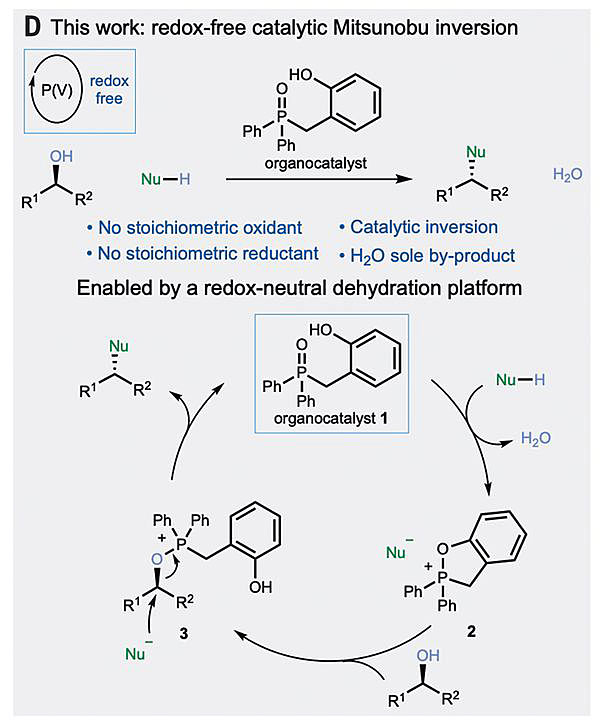
图3. 有机催化剂实现醇的直接亲核取代反应。图片来源:Science
于是,作者设计了基于氧化膦催化剂1的催化循环,并认为该催化剂在酸性前亲核试剂活化,发生环化、脱水,得到氧膦盐物种2。尽管看上去,断裂膦氧双键的转化非常具有挑战性,文献中确实报道了含有两个羟基芳基的氧化膦实现了200度下热脱水生成可稳定分离的五价膦烷物种。作为一种经典的Mitsunobu反应,氧膦盐2的抗衡阴离子可能会参与不涉及产物形成、可逆的键形成和交换,并最终醇开环转化为传统的中间体即烷氧基膦-亲核试剂离子对3。接着发生亲核取代,释放抗衡阴离子而重生催化剂氧化膦1(图3)。因为没有氧化还原价态的改变,只有水一个副产物,该策略确实让人眼前一亮。
在对反应条件进行筛选过后,作者尝试了各种底物。发现这个新的有机催化剂和经典的Mitsunobu反应一样,能高效的通过醇的亲核取代反应实现C-O键(醇和酸)、C-N键(醇和酰胺)以及C-S键(醇和硫代酸)的构建,还能用于醚(醇和醇生成C-O键)的制备,同时,在反应中手性醇分子的构象也发生反转。值得一提的是,在传统的Mitsunobu反应中,由于加入了三苯基膦,因而底物中不能存在活泼卤代烃以及叠氮基团,但在新的这个体系中,由于整个过程中P的价态都是五价,因而这两种官能团的底物也能进行Mitsunobu反应了(图4中5h和5i)。
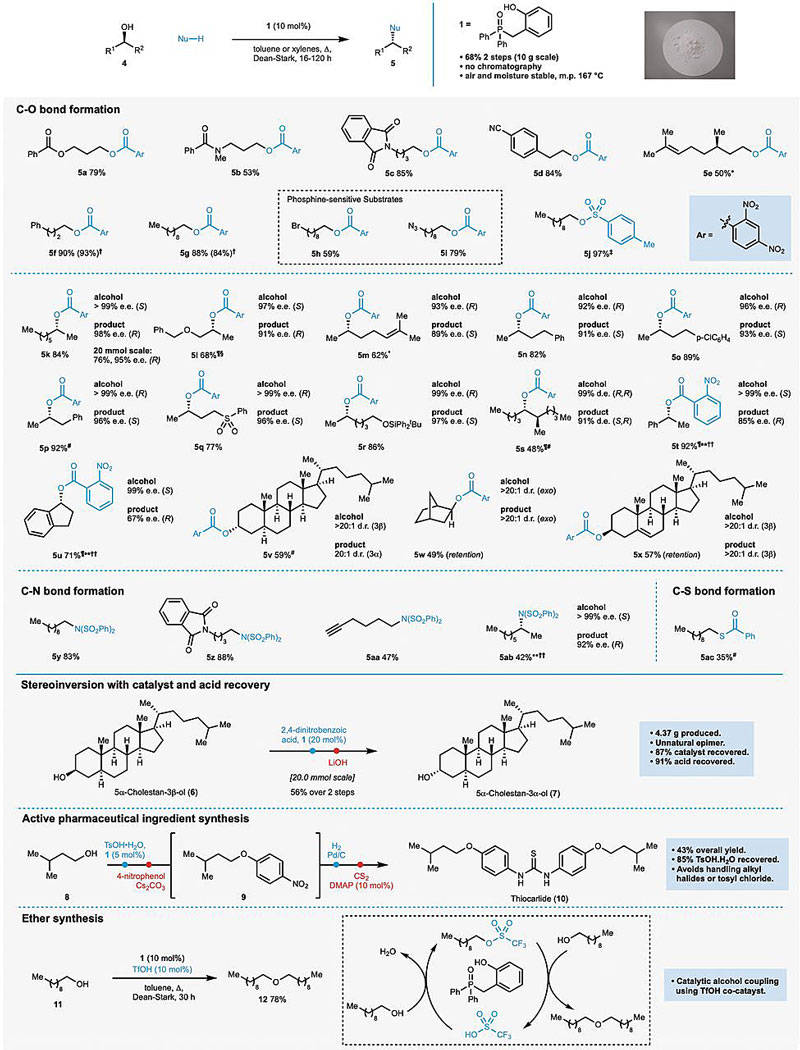
图4. 底物拓展 图片来源:Science
空口无凭,那么机理到底是不是如作者一开始设想的那样呢?除了手性反转的证据外,他们做了几个实验验证关于机理的猜测(图5)。首先是同位素标记实验,用18O对醇上的氧原子进行标记,发现反应结束后的酯基产物分子是高度被16O标记的,而回收的催化剂上则有74%被18O标记,这些结果加上二级醇底物的优秀对映选择性,支持了上述机理猜想中氧从醇转移到催化剂上的设想。随后,作者通过几个对照实验,说明原有分子设计中能形成环状中间体的特殊结构对于催化过程的重要性,间接证明了中间体2的存在,而其他催化剂立体选择性的丧失可能与反应经历了Fischer酯化和消旋化的SN1机理。进一步的,作者通过核磁及合成中间体2和3,证明它们可以和原有催化剂分子1一样参与催化反应。最后,作者得出结论,脱水形成中间体膦盐或许是决速步,并严重依赖于几何空间上有利的酚羟基官能团,单纯的氢键不足以提供反应所需的活性;而同位素标记实验及立体构型翻转实验则与经典的Mitsunobu反应机理一致。
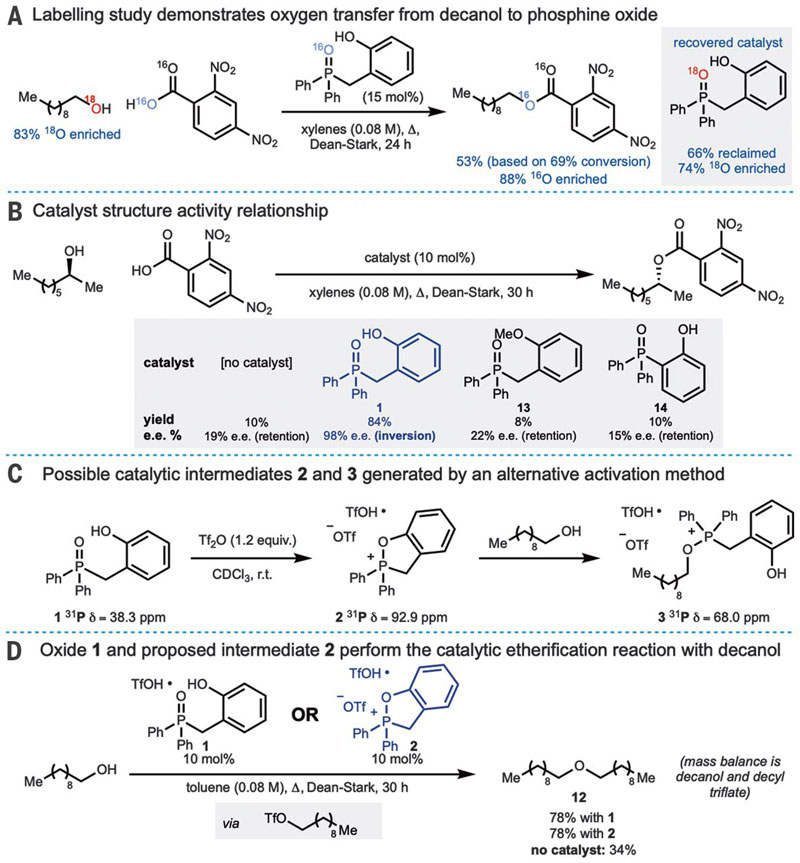
图5. 催化机理的证明。图片来源:Science
这个催化剂合成一点也不难,能够克级合成,2-3步反应搞定,合成过程也不需要过柱子,对空气也不敏感。而且,在反应后过个柱子就可以把大部分催化剂回收,并且催化效果一点也没有打折。简直是满足了对一个催化剂的所有想象。
如果你心中也有“Dream reaction”,愿你有朝一日也能实现它!
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Redox-neutral organocatalytic Mitsunobu reactions
Rhydian H. Beddoe, Keith G. Andrews, Valentin Magné, James D. Cuthbertson, Jan Saska, Andrew L. Shannon-Little, Stephen E. Shanahan, Helen F. Sneddon, Ross M. Denton
Science, 2019, 365, 910-914, DOI: 10.1126/science.aax3353
导师介绍
Ross M. Denton
https://www.x-mol.com/university/faculty/40841
参考文献:
1. The Mitsunobu reaction, reimagined
https://science.sciencemag.org/content/365/6456/866
 0
0










