本世纪最大的生物科学突破莫过于基于CRISPR系统的基因编辑技术。CRISPR是自然界细菌进化出的一种免疫机制用于CRIPSR RNA 引导的病毒基因片段剪切。因其的可编辑性,高准确度,CRISPR系统被广泛的用于寻找目标基因以及基因剪切。近日,凯斯西储大学(Case Western Reserve University)电子设计中心团队的Yifan Dai 博士与美国国家医学院院士Arnold Caplan教授合作通过探索CRISPR Cas12a 的非特异性的基因剪切机理(trans-cleavage activity),使用电化学来监测CRISPR Cas12a 的功能活性,构建了一个基于电传感的CRISPR 生物传感器(E-CRISPR)可用于蛋白以及核酸病毒的检测。研究展示了用E-CRISPR检测HPV-16 病毒(人类乳头状病毒)以及PB-19(红细胞病毒)的基因序列。
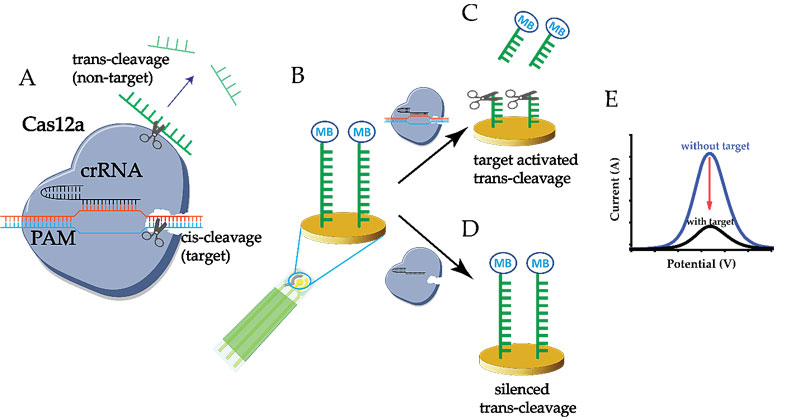
首先,CRISPR Cas12a是由Cas12a 蛋白以及crRNA 组成。Cas12a识别特定的目标DNA 上的PAM 序列,识别后Cas12a蛋白会进行解旋双链DNA,允许crRNA介入目标序列的后续核酸互补性识别。完成识别后,CRISPR Cas12a会进行目标DNA的剪切 (cis-cleavage)。目标DNA的剪切活动会诱导出Cas12a蛋白的非特异性剪切 (trans-cleavage activity),使Cas12a蛋白成为了一个ssDNA 剪切酶。因此,只当有目标DNA存在的时候,Cas12a蛋白的非特异性,单链DNA的剪切功能才会被激活。为了基于CRISPR的剪切能力来构建电化学生物传感器, 通过ssDNA probe 固定在电极上,可直接通过电化学探针的电流信号变化来显示CRISPR Cas12a 的剪切活性,非特异性剪切的强度可用于指出目标基因序列的浓度。不仅于DNA的检测,作者还后续设计了一个基于E-CRISPR的蛋白检测方法。使用核酸适配体来进行对应蛋白的识别,通过E-CRISPR来分析核酸适配体的浓度,可反向表出蛋白浓度。
综上所述,该工作通过探索CRISPR Cas12a的非特异性剪切功能,构建了一个基于电化学和CRISPR的高精度生物检测平台。通过设计E-CRIPSR的使用方法,该平台可广泛用于蛋白和核酸的检测。
相关工作发表在Angewandte Chemie International Edition上。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Exploring the Trans-Cleavage Activity of CRISPR‐Cas12a (cpf1) for the Development of a Universal Electrochemical Biosensor
Yifan Dai, Rodrigo A Somoza, Liu Wang, Jean F. Welter, Yan Li, Arnold I Caplan, Chung Chiun Liu
Angew. Chem. Int. Ed., 2019, DOI: 10.1002/anie.201910772
 0
0










