烯烃是有机化合物中最常见的结构单元,它的双官能团化是有机合成方法学中研究最广泛的课题之一。近年来,光催化方法可以用来高效的生成氮自由基,它可用与和烯烃反应形成反马氏加成的胺化产物。此外,吡啶是许多天然产物、药物、农药和精细化学品的基本结构单元(图1a)。如果能够开发一种高效方法学,利用光催化技术通过单步反应就能实现分子间烯烃氨基吡啶双官能团化,这将会具有极高的原子经济性和步骤经济性。吡啶类化合物C2位的Minisci类型烷基化已经得到了很好的证实,但往往会在C6位上过度烷基化形成单取代和双取代的混合物(图1b)。N-氨基吡啶盐中生成氮中心的自由基在光催化系统中被证明是可行的,其中吡啶通常被当作了副产物。如果将N-氨基吡啶盐作为双官能团试剂,能否将氨基自由基和吡啶同时引入烯烃(图1d)?在此过程中,吡啶盐上有两个竞争位点(C2和C4),如何解决区域选择性将可能是另外一个困难。
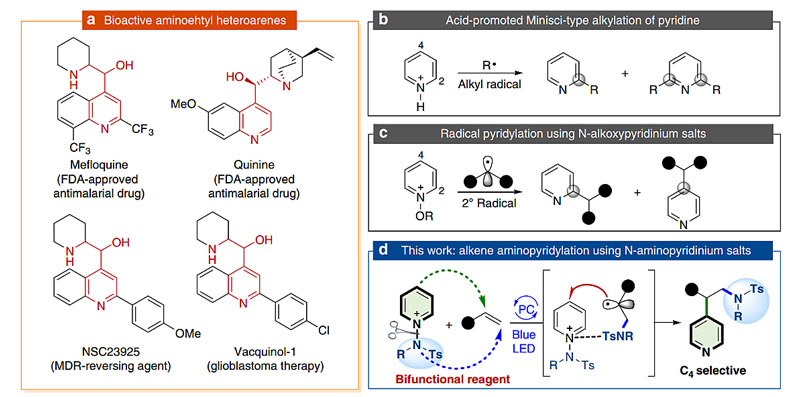
图1. 烯烃双官能团化。图片来源:Nat. Commun.
韩国基础科学研究所(IBS)的Sungwoo Hong教授(点击查看介绍)课题组一直致力于吡啶盐类化合物在可见光反应中的应用(J. Am. Chem. Soc., 2019, 141, 9239;Angew. Chem. Int. Ed., 2018, 57, 15517;Green Chem., 2019, 21, 2082),最近,他们和Mu-Hyun Baik教授(点击查看介绍)课题组共同报道了一种利用N-氨基吡啶盐作为胺化试剂和吡啶化试剂,在温和的光催化反应条件下同时实现了烯烃的氨基化和吡啶化反应。该策略以曙红Y(Eosin Y)为光催化剂,不需要任何额外氧化剂。值得注意的是,N-氨基吡啶盐C4位置的区域选择性可以通过吡啶氮与β-氨基自由基的磺酰基之间的静电相互作用来控制。该转化具有底物范围普适性广、官能团相容性好等特点,对复杂生物分子的后期官能团化进一步证实了该方法的实用性,作者还结合实验和DFT计算对反应机理进行了研究。相关结果发表于Nature Communications。
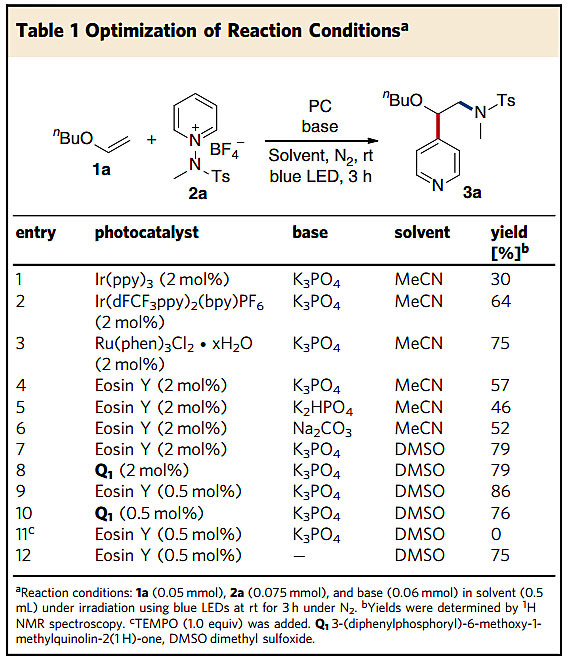
图2. 反应条件的优化。图片来源:Nat. Commun.
作者使用乙烯基醚1a和N-氨基吡啶盐2a作为模板底物,在乙腈中使用Ir(ppy)3室温下实现了烯烃的1,2-氨基吡啶化反应,以30%的收率得到了预期的产物3a(图2,entry 1),这表明了以N-氨基吡啶盐作为烯烃的双官能团化试剂是可行的,并且反应选择性地发生在吡啶的C4位置。通过对催化剂、溶剂以及碱等因素的筛选,最终得出了最优的反应条件(entry 9)。控制实验表明光照和光催化剂在这个反应中是必不可少的因素;当在TEMPO存在的条件下,反应没有进行,进一步支持了这个反应涉及到自由基机理过程。在没有碱的情况下,产物3a的收率为75%,这说明不需要外加碱,产物吡啶在反应过程中可能作为碱。
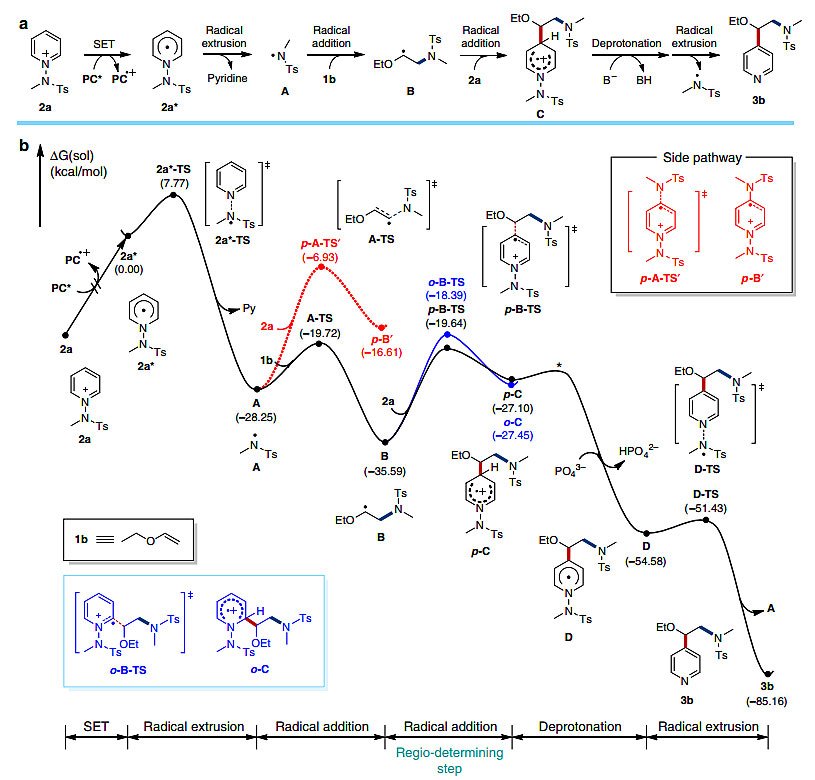
图3. 可能的反应机理。图片来源:Nat. Commun.
在以往对N-烷氧基吡啶盐的研究中,叔烷基自由基主要得到吡啶C4位产物,而仲烷基自由基对C2位具有中等的选择性。而本文中的烯烃碳的空间位阻相对较小,实验结果的高C4位置选择性令人惊讶。该反应中涉及到自由基形成、N-N键的裂解、胺化和吡啶化等步骤,但其反应顺序以及高的区域选择性都不清楚,为了对机理进行理解,作者基于密度泛函理论(DFT)进行了量子化学计算。
计算表明,N中心自由基作为亲电试剂对烯烃加成,形成的烷基自由基作为亲核试剂与吡啶底物反应,自由基加成步骤B→C很可能是决速步,也是区域选择性的原因。虽然两种区域异构体p-C和o-C的自由能几乎相同,分别为-27.1 kcal/mol和-27.4 kcal/mol,但C4中间体p-C的过渡态p-B-TS比C2的能量低1.3 kcal/mol,与实验观察到的区域选择性一致。对o-B-TS和p-B-TS的键能分析表明,相互作用能的差异是由于吡啶底物中部分带负电荷的磺酰氧与正极化的氮之间在2.98 Å的距离上存在额外的非共价吸引,这种相互作用不可能在o-B-TS结构中实现。
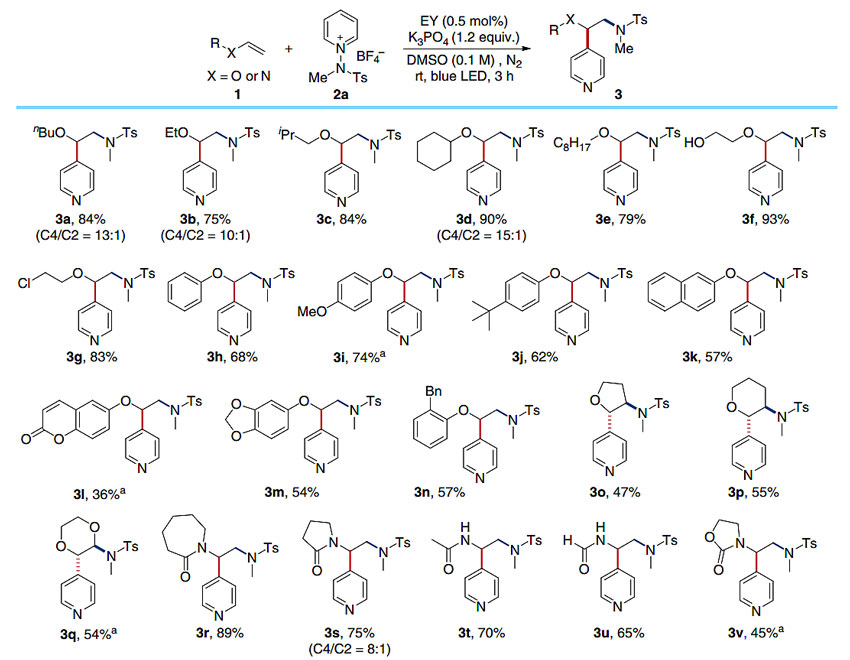
图4. 烯烃的范围。图片来源:Nat. Commun.
基于对机理的理解,作者对底物的范围进行了研究。如图4所示,首先针对不同的烯烃进行考察。不同的富电子烯烃,如烯基醚和烯基胺均能以优异的C4区域选择性得到β-氨基吡啶衍生物。不同链长的脂肪族乙烯基醚(3a-3e)和具有极性官能团的底物(3f和3g,羟基和氯),均以良好的收率得到目标产物。除了脂肪族乙烯基醚和端烯基醚,芳基乙烯基醚(3h-3n)和内部烯烃醚类(3o-3q)也能适用于该反应。值得注意的是,该反应还可以扩展到乙烯基酰胺类化合物,例如酰胺和氨基甲酸酯类均能产生相应的产物(3r-3v)。1a和2a在2.0 mmol的规模能以83%的收率得到目标产物3a证明该方法的实用性。
为了进一步验证该反应的普遍性,作者对N-氨基吡啶盐的范围也进行了考察。如图5所示,底物中含有供电子或缺电子基团,如含有甲基、甲氧基和酯基的吡啶类衍生物均成功地得到了目标产物(4a-4d)。由于2-芳基吡啶结构在药物化学和材料科学中的重要性,也对含有这类结构的底物进行了评估(4e-4g)。在吡啶C3位含有甲基、苯基、甲氧基、酯基或溴的底物(4h-4l)和双环吡啶底物(4m)均能得到了期望的产物。当N-磺酰胺的甲基被乙基(4n)、丙基(4o)、三氟乙基(4p)、苯丙基(4q)等替代,或磺酰基被甲酰基(4r)替代时,最终都能以较高的收率得到相应的产物。
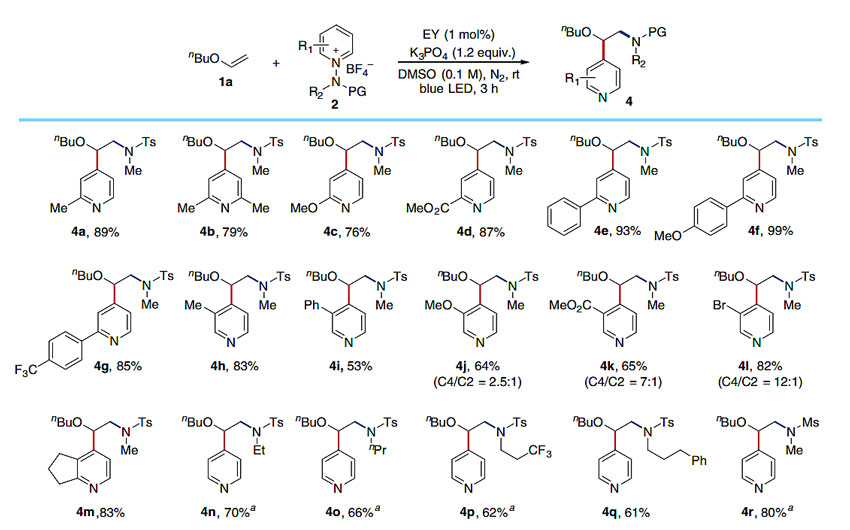
图5. 吡啶盐的范围。图片来源:Nat. Commun.
为了证明该方法具有更加广泛的合成用途,对其在复杂的生物分子后期修饰上进行了评估(图6)。在标准反应条件下,氨基酸衍生物L-丝氨酸和L-酪氨酸、D-果糖、雌激素酮、β-香茅醇、蚊蝇醚(pyriproxyfen)和比沙可啶(bisacodyl)的衍生物均能以中等收率得到相应的产物。因此,这些结果突出了该方法在复杂分子中对酯、酮、酰胺、缩醛、醚、吡啶等官能团的高耐受性。
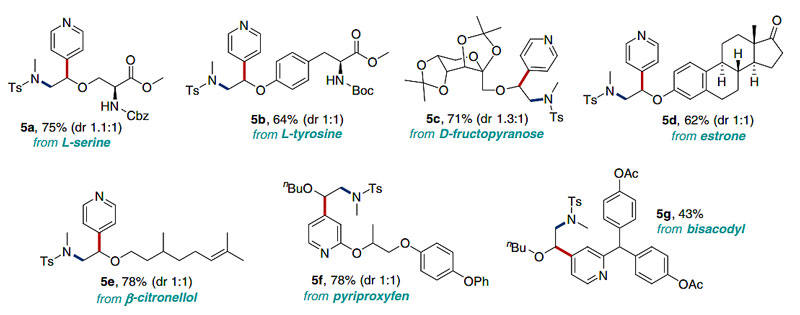
图6. 生物分子后期修饰。图片来源:Nat. Commun.
最后,作者对机理进行了更深入的研究。动力学同位素实验表明脱质子步骤不是决速步(图7a)。接下来,为了确定单电子转移原位生成的吡啶是否作为底物,将2a和2-对甲氧基苯基吡啶的混合物在标准反应条件进行反应(图7b),结果只有2a参与了氨基吡啶化过程。Stern-Volmer荧光淬灭实验表明,激发态曙红Y的淬灭变化与2a的浓度成正比,循环伏安法测量的吡啶盐2a的还原电位为-0.73 V,这表明光催化循环可能以氧化淬灭的过程来进行。此外,紫外吸收光谱排除了EDA复合物形成的可能。
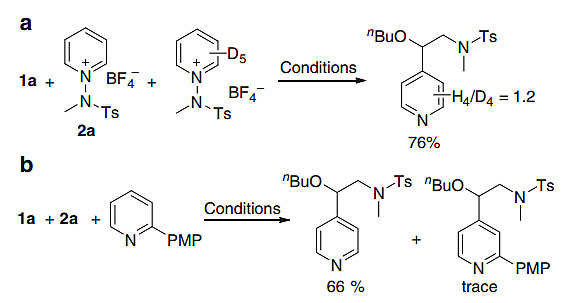
图7. 机理研究。图片来源:Nat. Commun.
总结
Sungwoo Hong和Mu-Hyun Baik等研究者报道了一种可见光诱导的烯烃1,2-氨基吡啶化反应,其中,N-氨基吡啶盐作为高效双官能团化试剂——它既可作为胺化试剂,又可作为吡啶化试剂。结合实验和DFT计算,对自由基俘获过程中区域选择性进行了详细的解释,吡啶氮与β-氨基自由基中的磺酰基之间的静电相互作用导致了吡啶C4位置的区域选择性。该策略为烯烃氨基吡啶化反应提供了一种方便、高效的合成手段,并且还能应用于复杂生物分子的后期修饰。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Visible light induced alkene aminopyridylation using N-aminopyridinium salts as bifunctional reagents
Yonghoon Moon, Bohyun Park, Inwon Kim, Gyumin Kang, Sanghoon Shin, Dahye Kang, Mu-Hyun Baik, Sungwoo Hong
Nat. Commun., 2019, 10, 4117, DOI: 10.1038/s41467-019-12216-3
导师介绍
Sungwoo Hong
https://www.x-mol.com/university/faculty/4497
Mu-Hyun Baik
https://www.x-mol.com/university/faculty/47857
(本文由有所不为供稿)
 0
0











