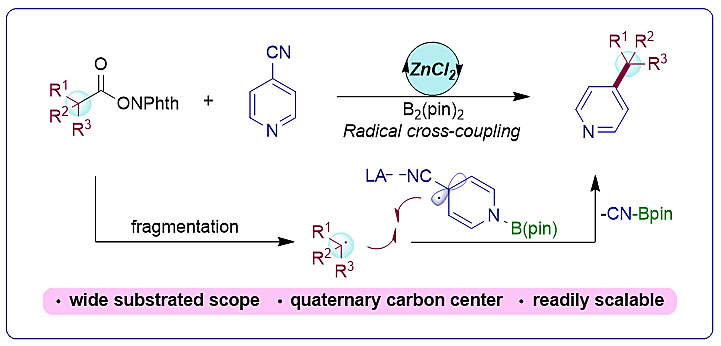
烯基卤代物是一种多功能官能团,可用于构建各种碳-碳键和碳-杂原子键,如常用作过渡金属催化的交叉偶联反应的底物,或者通过金属卤素交换反应转化成亲核试剂,从而对羰基化合物进行1,2-加成(图1)。此外,烯基卤化物也存在于一些天然产物和生物活性分子中。大部分环烯卤代物都是由相应的酮合成的,一种常用的方法是Barton烯基卤代物合成法,其中间体为腙。但在大位阻底物上形成所需的腙极具挑战性,卤化步骤常常产生烯基卤代物异构体或二卤代副产物。
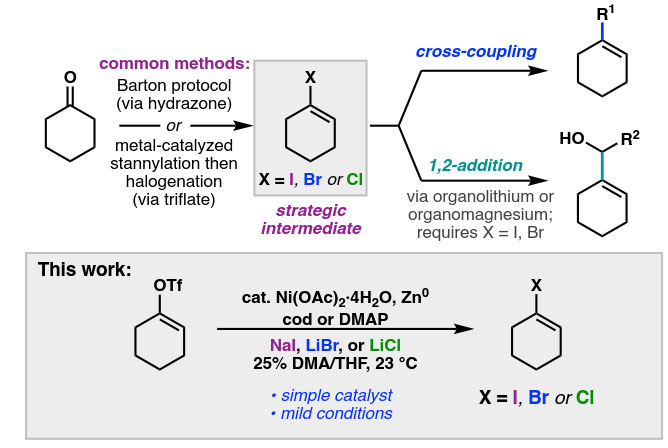
图1. 烯基卤代物的合成及应用。图片来源:Angew. Chem. Int. Ed.
直接从环状酮出发,在动力学或热力学控制下制备烯醇三氟甲磺酸酯已成为过渡金属催化的交叉偶联过程中重要的“拟卤代物”。然而,烯醇三氟甲磺酸酯不能直接转化为1,2-加成反应中使用的相应的烯基锂或烯基镁物种。在Barton烯基卤代物合成产率较差的情况下,经常需要多步反应来改善:(1)将酮转化为烯醇三氟甲磺酸酯,(2)将三氟甲磺酸酯转化为锡烷,(3)将锡烷转化为卤代物。利用直接、温和的方法将烯醇三氟甲磺酸酯直接转化为烯基卤代物,而不经过有机锡中间体,则可以简化这些重要合成子的制备。
事实上,Buchwald课题组报道过一种Pd-催化反应(J. Am. Chem. Soc., 2010, 132, 14076),可将烯醇三氟甲磺酸酯转化为烯基溴代物和氯代物;然而,该反应不能生成烯基碘代物,而且该反应需要昂贵的配体、高温以及氟盐或iBu3Al等添加剂,这导致了官能团的兼容性受阻。Hayashi课题组报道了一种Ru-催化的方法(J. Am. Chem. Soc., 2012, 134, 14760),可将烯醇三氟甲磺酸酯在室温下转化为碘化物、溴化物或氯化物;然而,所需的Ru-催化剂不是商业可得的,并且形成烯基碘化物的实例也有限。
通过对Ni-催化烯基溴化物不对称还原偶联反应的研究,加州理工学院的Sarah E. Reisman教授(点击查看介绍)课题组观察到了烯基氯化物和碘化物的卤素交换过程。尽管先前已经报道并广泛研究了镍催化的芳基和烯基卤素交换过程,但是烯醇三氟甲磺酸酯的相应反应报道却极少。近期在Angew. Chem. Int. Ed.上,Reisman教授课题组报道了Ni催化的三氟甲磺酸酯-卤化物交换(triflex)反应,能够以优良的产率制备烯基碘化物、溴化物和氯化物(图1)。
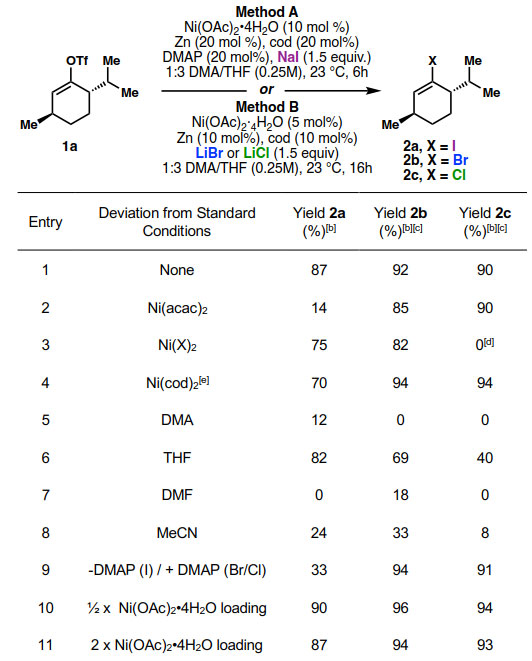
图2. 反应条件优化。图片来源:Angew. Chem. Int. Ed.
作者以从薄荷酮一步制得的烯醇三氟甲磺酸酯1a为模型底物,通过改变卤化物盐来确定制备烯基碘、溴或氯化物的普适性条件(图2)。Ni(cod)2为催化剂,DMA/THF为混合溶剂,在较短的反应时间内,反应效果是最优的,但是双齿配体(膦、胺和吡啶)对反应有抑制作用。根据这些结果,作者结合Zn0和cod筛选了多种Ni(II)预催化剂,最终发现Ni(OAc)2•4H2O在这三种反应中都有良好的产率。使用5 mol % Ni(OAc)2•4H2O和10 mol % cod(方法B)反应16 h可以良好的产率得到烯基溴化物和氯化物,然而在此条件下碘化反应产率较低。为了提高碘化反应的收率,作者筛选了添加剂。结果表明向反应体系中加入20 mol % DMAP以及较高的催化剂载量,例如10 mol % Ni(OAc)2、10 mol % cod能够提高2a的收率。由于在DMAP存在和不存在的情况下2b和2c产率比较相似,因此在标准溴化和氯化条件下不用DMAP。虽然用5 mol % Ni也可以获得高收率的2a,但在碘化反应底物拓展中,许多底物都转化不完全。将Ni载量增加到10 mol %可以提高转化率,缩短反应时间,这对于减少还原产物的形成是必要的(方法A)。
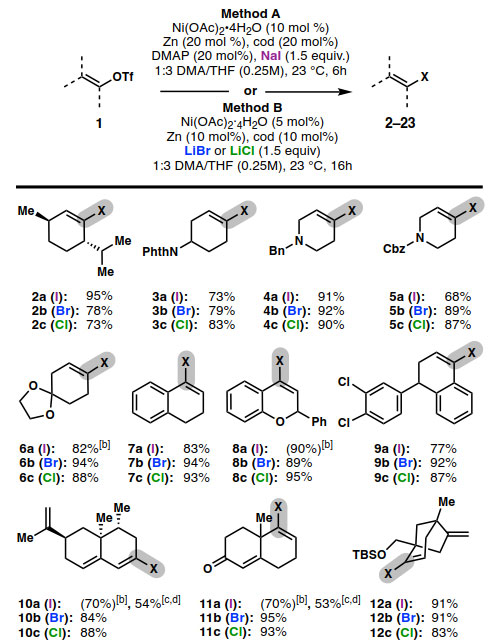
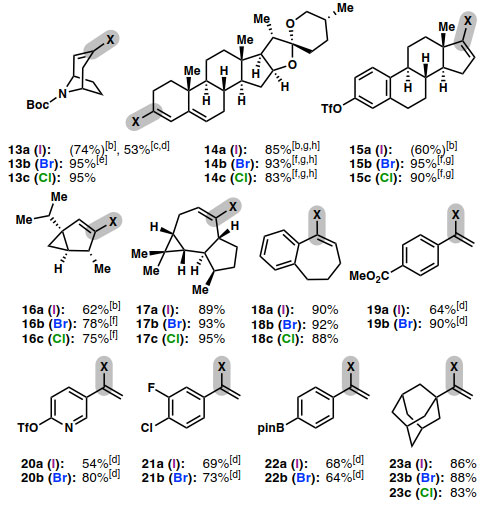
图3. 烯基卤代物底物扩展。图片来源:Angew. Chem. Int. Ed.
有了最佳反应条件,作者考察了Ni-催化卤化反应的底物范围(图3)。该反应能够兼容各种常见官能团,包括胺(4)、氨基甲酸酯(5、13)、吡啶(20)、烯烃(12)、二烯(10、14)、酯(19)、缩酮(6、14)和烯酮(11)。在芳基三氟甲磺酸酯(15、20)、芳基氯化物(9、21)和芳基硼酸酯(22)共存的情况下,烯基三氟甲磺酸酯化学选择性卤化;然而,在芳基溴化物和碘化物的存在下会有竞争性的卤素交换。
尽管Ni-催化的卤化反应表现出良好的官能团耐受性,但是碘化、溴化和氯化反应结果却不同。碘化反应条件(方法A)对于约一半的底物是最佳的。在碘化反应迟缓的情况下(6、8、10、11、13-16),延长反应时间或加入5.0当量的NaI会提高转化率;然而,改进的反应常常伴随着脱卤(约5-10%的产率),并且烯烃难以与烯基碘化物(8a、10a、11a、13a、15a)选择性分离。对于这些底物(10、11、13),通过使用Ni(cod)2和烯醇九氟丁基磺酰酯(enol nonaflate)来消除竞争性的还原反应,这提供了纯烯基碘化物的制备方法。
溴化反应和氯化反应一般更有效、更可靠。在大多数底物中,完全转化是用5 mol % 的Ni,而不需要DMAP。此外,对于1-芳基乙烯基三氟甲磺酸酯,使用Ni(cod)2 (方法C)使得溴化和碘化反应更彻底。为了证明反应的可扩展性,作者在1 mmol规模上合成了溴化产物13b,产率为95%。
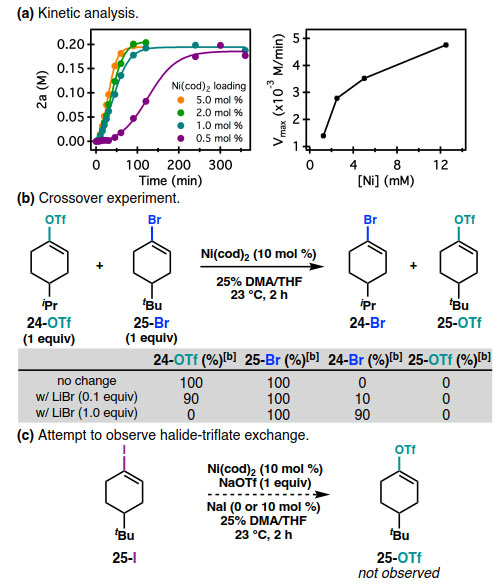
图4. 机理研究。图片来源:Angew. Chem. Int. Ed.
目前,这一反应的机理尚不清楚。以Ni(cod)2为催化剂的碘化反应的初步研究表明1a的反应在低[Ni]载量(如0.5 mol %、1 mol %)时具有诱导期。Vmaxvs. [Ni]曲线表明该反应对[Ni]具有正相关性,在[Ni]量较高时呈现负偏离一级关系,表明在较高量的[Ni]形成了二聚体(或更高阶)的非循环物种。当NaI超过1当量时,1a的碘化速率没有变化,但对[1a]的速率依赖性更复杂。一种可能是,诱导期需要形成一个活性的NiI催化剂。在反应过程中,EPR光谱中存在一个与NiI-X物种相一致的信号。然而,对这一信号的量化结果表明,它仅占总[Ni]的2%。
作者还设计了一个交叉实验来考察三氟甲磺酸酯-卤化物交换的可逆性:在23 °C下,在1:3 DMA/THF和Ni(cod)2(10 mol %)条件下处理1:1的24-OTf和25-Br混合物,结果24-OTf和25-Br全部回收,没有检测到交叉产物25-OTf或24-Br。加入0.1或1.0当量LiBr使24-OTf转化为24-Br,产率分别为10%和90%;在任何一个反应中,均未检测到25-OTf。用1H NMR监测反应,在没有卤化物盐的情况下,24-OTf没有发生氧化加成。将烯基碘25-I加入到Ni(cod)2(10 mol %)和三氟甲磺酸盐(如NaOTf)中,没有烯醇三氟甲磺酸酯的形成。综上所述,烯醇三氟甲磺酸酯的氧化加成是不可逆的,或者卤化物在氧化加成复合物中对三氟甲磺酸酯的交换是快速和不可逆的。在这两种情况下,烯醇三氟甲磺酸酯被不可逆地消耗,使得反应能够以良好的产率进行得到各自的烯基卤化物。这与Ni-催化的卤化物交换反应不同,后者是热力学驱动的平衡过程,例如,25-Br与LiI,或25-I与LiBr在Ni催化下反应2 h后,都得到85:15的25-Br:25-I混合物。
总结
Sarah E. Reisman教授课题组报道了一种温和的Ni-催化烯醇三氟甲磺酸酯的卤化反应,通过改变卤化物盐,可以一个简单、廉价的催化剂体系得到烯基碘化物、溴化物或氯化物。这些反应在室温下进行,产率优良,官能团兼容性良好,可用于重要有机合成子的制备。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Nickel‐Catalyzed Conversion of Enol Triflates into Alkenyl Halides
Julie L. Hofstra, Kelsey E. Poremba, Alex M. Shimozono, Sarah E. Reisman
Angew. Chem. Int. Ed., 2019, 58, 14901-14905, DOI: 10.1002/anie.201906815
导师介绍
Sarah E. Reisman
https://www.x-mol.com/university/faculty/466
 0
0