不对称膦催化在过去十年内取得了很多突破性进展(Chem. Rev., 2018, 118, 9344),各种新的手性膦催化剂陆续报道并在很多催化反应中取得了很好的催化效果。新加坡国立大学卢一新教授团队发展了一系列氨基酸衍生的有机膦催化剂(Acc. Chem. Res., 2016, 49, 1369),并把它们应用到一系列不对称反应中,包括各种环加成反应(Angew. Chem. Int. Ed., 2019, 58, 6260; Angew. Chem. Int. Ed., 2019, 58, 5427; Angew. Chem. Int. Ed., 2017, 56, 14222)、γ加成反应(J. Am. Chem. Soc., 2016, 138, 265)、MBH反应、Rauhut−Currier反应等。在金属催化的不对称反应中,手性膦配体起着至关重要的作用,其设计合成受到广泛的关注。其中手性螺环配体是通用性最好的手性配体之一,但是由于光学纯全碳螺环配体中手性季碳的构建十分困难,存在合成和拆分步骤繁琐等局限性,手性螺环骨架高效、不对称催化合成极具挑战性。中国科学院上海有机化学研究所丁奎岭院士团队长期致力于手性配体的设计,最近设计并实现了光学活性环己烷稠合螺二氢茚骨架的高效、催化不对称合成(J. Am. Chem. Soc., 2008, 140, 10374)。该方法以良好的总收率和最高>99%的ee 值获得一系列手性环己烷稠合螺二氢茚骨架,配体合成可以25克的量级规模高效获得近乎光学纯的环己烷稠合螺二氢茚二酚chf-SPINOL,整个过程不需要柱色谱纯化,极大地方便了相应手性配体的实用合成。
近来,卢一新教授团队和丁奎岭院士团队合作发展了一种以环己烷稠合螺二氢茚二酚chf-SPINOL为原料、在温和条件下合成具有C2对称轴的螺环手性膦配体的方法,该配体命名NUSIOC-Phos,体现了新加坡国立大学(NUS)和上海有机化学研究所(SIOC)的密切合作。NUSIOC-Phos具有稠合环己烷的螺环骨架,磷原子连接着两个烷基链,增强了亲核性并增大了位阻,带有这种刚性结构的膦配体可以在催化中更好地控制手性。作者研究发现,NUSIOC-Phos在高对映选择性构建结构新颖的三环γ内酰胺过程中具有特别好的效果,产率高,非对映选择性高(>20:1),对映选择性大部分大于99%。此外,NUSIOC-Phos还能用于外消旋γ-取代联烯酯的动力学拆分,得到手性联烯酯。相关论文发表于J. Am. Chem. Soc.,第一作者为新加坡国立大学的博士研究生吴明月。
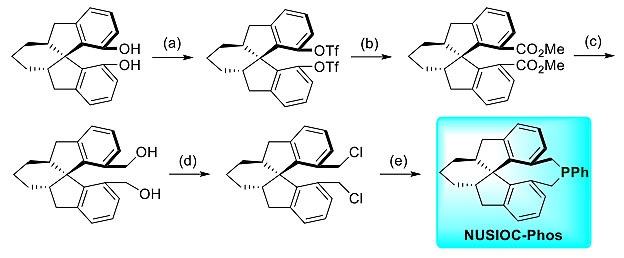
图1. 合成NUSIOC-Phos。图片来源:J. Am. Chem. Soc.
在现代有机合成化学中,高效高立体选择性地合成具有复杂结构的分子是一个长期存在的难题。多环结构的γ内酰胺是药物化学和天然产物中常见的生物活性分子(图2)。这些分子通常存在多个手性中心,非常拥挤的γ内酰胺骨架还埋在多环体系中,使得它们的合成非常具有挑战性。目前,选择性催化合成具有三个环的螺环手性骨架的γ内酰胺还没有报道。
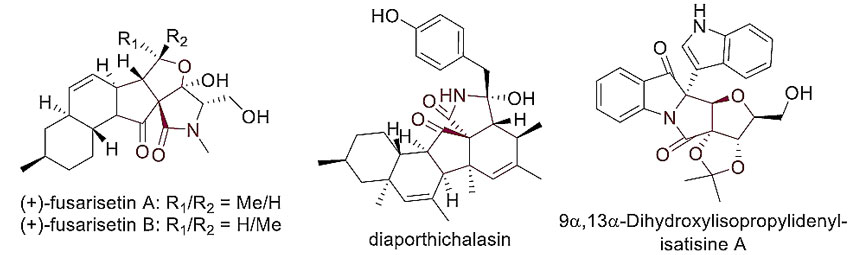
图2. 具有三环γ内酰胺骨架的天然产物。图片来源:J. Am. Chem. Soc.
作者设想可以尝试着从吡咯烷-2,3-二酮和γ取代联烯酯出发,在手性膦的催化下,经过多米诺反应来实现一系列预期的转化,从而得到具有复杂结构的γ内酰胺(图3)。
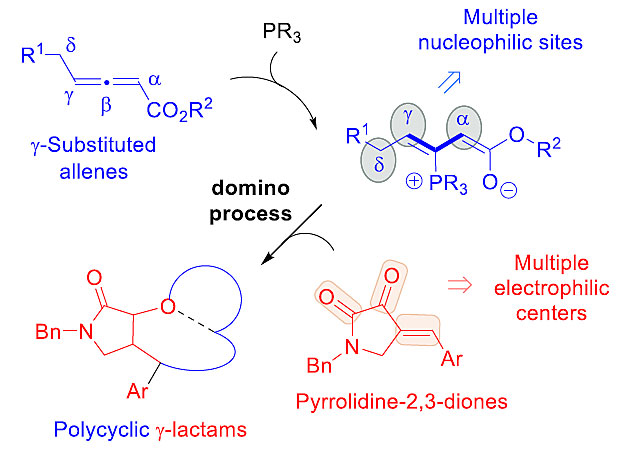
图3. 对映选择性合成三环γ内酰胺设想。图片来源:J. Am. Chem. Soc.
作者首先以吡咯烷-2,3-二酮(1a)与γ取代联烯酯(2a)作为模板底物,在20 mol%氨基酸衍生的膦催化剂5a的作用下对该反应进行初步探索。反应以甲苯作为溶剂,室温条件下便可以顺利进行,以23%的收率及-30%的对映选择性得到目标产物3a。由此说明,膦催化以吡咯烷-2,3-二酮与γ取代联烯酯为原料的多米诺反应构建多环γ内酰胺是完全可行的。随后作者对其他氨基酸衍生的催化剂和具有不同骨架结构与取代基的手性膦催化剂进行考察,发现使用NUSIOC-Phos可以取得最佳的反应结果。最终优化反应条件,以负载量10 mol%的NUSIOC-Phos作为催化剂,1,4-二氧六环作为溶剂,室温条件下以92%的分离收率、>99%的对映选择性得到三环γ内酰胺化合物(图4)。
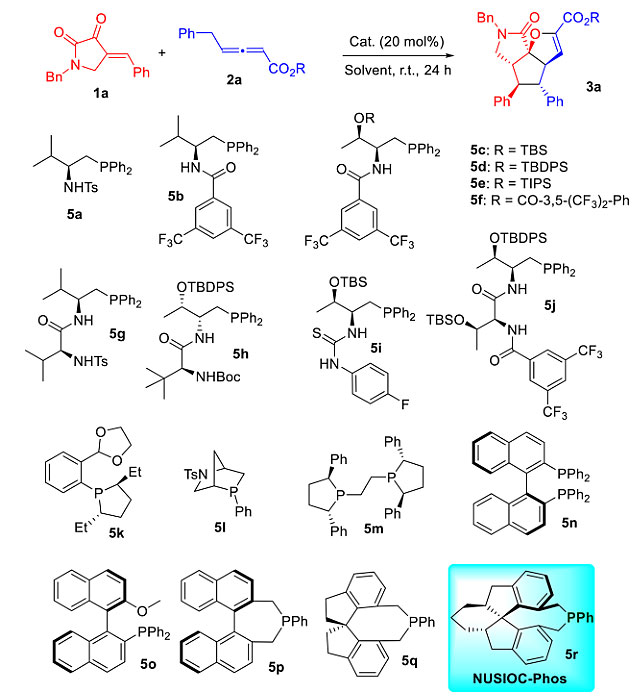
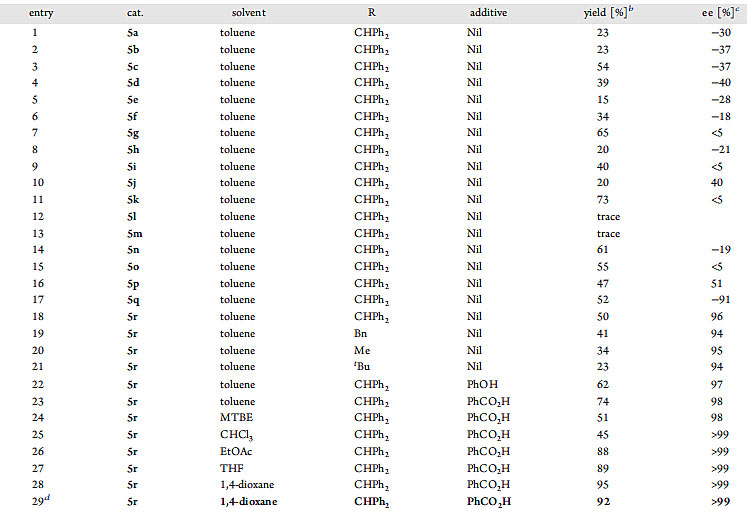
图4. 对映选择性合成三环γ内酰胺的条件优化。图片来源:J. Am. Chem. Soc.
随后作者对不同吡咯烷-2,3-二酮衍生物及γ取代联烯酯底物的适用范围进行考察。不同类型的酯修饰的吡咯烷-2,3-二酮衍生物和不同电性的联烯酯都可以顺利地发生反应,两种底物中芳环取代基的电子性质与取代位置对反应结果没有明显的影响。值得注意的是,δ烷基取代联烯酯也可以高对映选择性地得到目标产物(4n, 4o)。他们通过X射线单晶衍射表征对产物3j的绝对构型进行分析,并以此类推其他产物的构型(图5)。
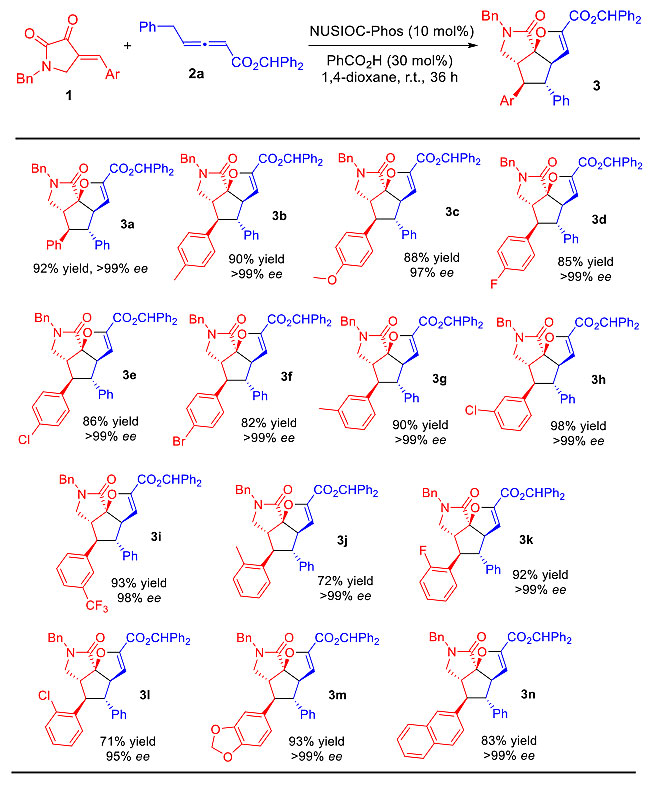

图5. 对映选择性合成三环γ内酰胺的底物拓展。图片来源:J. Am. Chem. Soc.
NUSIOC-Phos催化的多米诺反应在高效高选择性得到目标产物的同时,作者还有个有意思的发现——剩余的联烯酯也有一定的ee值。由此作者猜测,是否可以将NUSIOC-Phos用于联烯酯的动力学拆分?要知道,具有轴手性的联烯结构广泛存在于天然产物和活性分子中,不过高效率不对称合成这类化合物的方法却很少有报道。作者通过对溶剂和添加剂的条件优化,发现了在NUSIOC-Phos催化下的最优反应条件:以负载量20 mol%的邻乙酰基苯甲酸作为添加剂,1,4-二氧六环和甲苯作为混合溶剂,外消旋联烯酯2a能够以35%的分离收率、84%的对映选择性得到手性联烯酯R-2a;同时以51%的分离产率、>99% ee得到三环γ内酰胺3a(图6)。
图6. 动力学拆分条件优化。图片来源:J. Am. Chem. Soc.
随后作者也对动力学拆分γ取代联烯酯的底物范围进行了考察。不同类型的γ取代联烯酯可以顺利地发生反应,以中等的产率和良好的对映选择性得到手性联烯酯(图7)。值得一提的是,在这条件下得到的三环γ内酰胺都具体完美的ee值。通过对比联烯酸的旋光确定了联烯酯的绝对构型,并以此类推其他产物的构型。
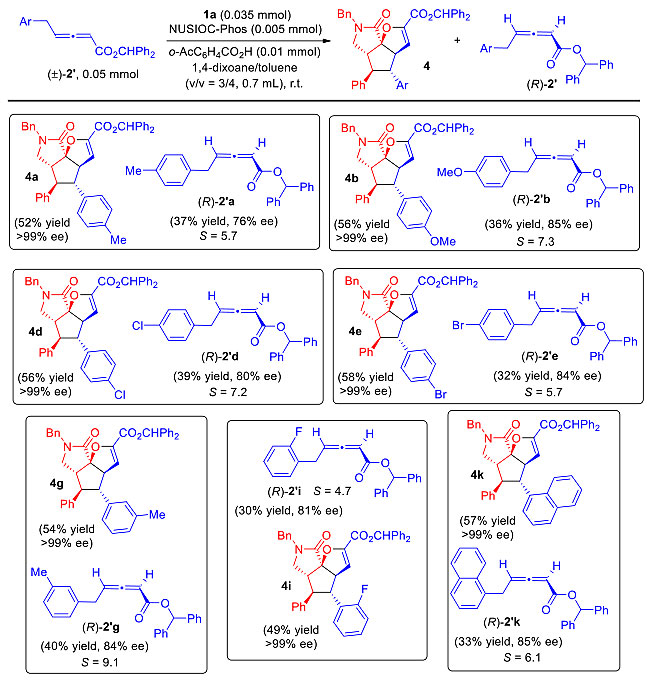
图7. 动力学拆分底物拓展。图片来源:J. Am. Chem. Soc.
作者提出了可能的反应机理(图8)。联烯酯经膦催化剂亲核进攻得到两性离子中间体int-1,经过1,4-氢转移得到中间体int-2,对吡咯烷-2,3-二酮进行共轭加成,得到中间体A。再通过1,4-氢转移和分子内亲核加成,得到中间体B。经过另一分子内加成得到中间体C,C经过1,2-氢转移和消除释放催化剂得到最终产物完成催化循环。
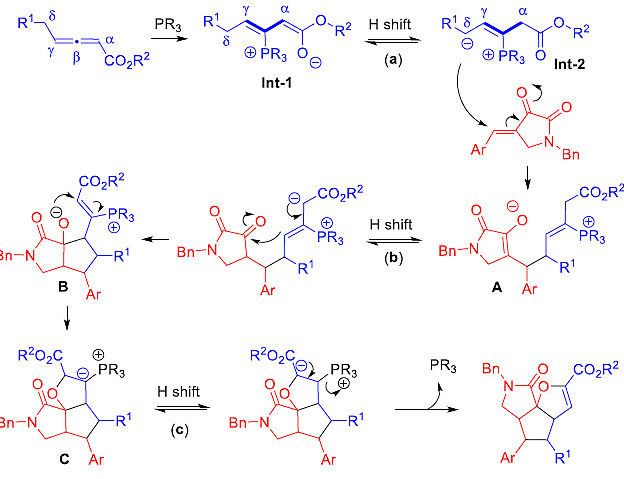
图8. 可能的反应机理。图片来源:J. Am. Chem. Soc.
随后作者又对提出的机理进行了实验验证,在同样的反应条件下对比了氘代的联烯和非氘代的联烯的反应活性。研究发现,手性加氘代水到反应体系中,产物检测到有三个位置部分氘代,由此说明氢转移发生在这几个碳上。当用纯的氘代联烯去反应时,发现产物有四个位置被部分氘代,产物3ab中D2百分含量等于91%(图9,(2)),说明这个位置没有发生氢转移。当氘代的联烯和非氘代的联烯以1比1去反应时,最后产物3ac中D2等于46%(减半),说明氘代的联烯对反应速率基本没有影响,由此说明,第一步氢转移不是决速步。作者还对氘代的联烯和非氘代的联烯在同等条件下测速率曲线,发现二者速率基本一样,这更证明了氢转移得到int-2不是决速步(图10)。最后,通过磷谱的跟踪实验,发现催化剂的主要存在状态是膦进攻联烯的第一步加合物,综合以上分析,中间体int-2对吡咯烷-2,3-二酮进行共轭加成是此反应的决速步。
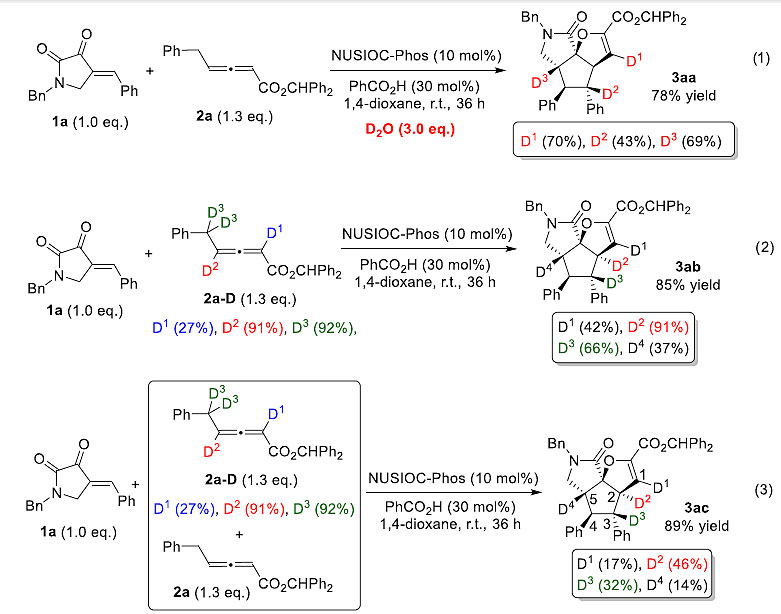
图9. 氘代实验。图片来源:J. Am. Chem. Soc.
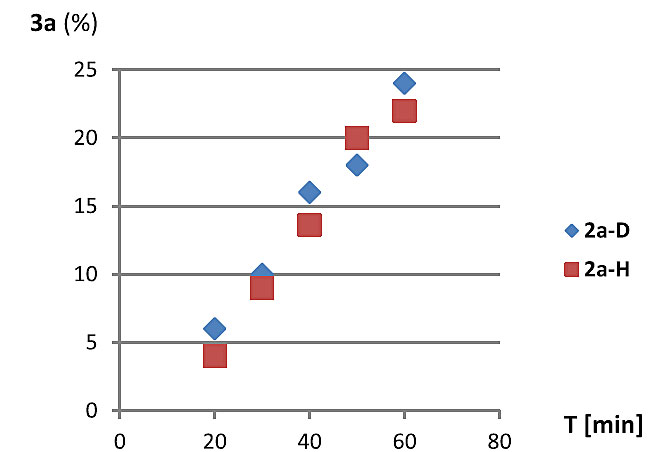
图10. 采用氘代的联烯和非氘代的联烯的初始速率。图片来源:J. Am. Chem. Soc.
最后,作者用有84% ee值的联烯酯进行反应,同样的反应条件下得到的3a产率降低到60%,这验证了之前的推想——不同构型的γ取代联烯酯在NUSIOC-Phos催化下反应活性不同,但反应的对映选择性并不受影响。催化剂对不同构型的联烯亲核加成速率有差别,这才使得动力学拆分有可能实现(图11)。
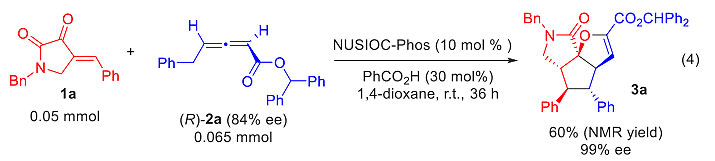
图11. 采用手性联烯酯进行反应。图片来源:J. Am. Chem. Soc.
总结
卢一新教授和丁奎岭院士等研究者报道了一种可由环己烷稠合螺二氢茚二酚chf-SPINOL在温和条件下制备的螺环手性膦催化剂NUSIOC-Phos。这种催化剂能够以高收率和近乎完美的对映选择性催化由吡咯烷-2,3-二酮和γ-取代联烯酯制备三环γ-内酰胺,此外,还可用于外消旋γ-取代联烯酯的动力学拆分,得到其他方法难以合成的手性联烯酯。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Cyclohexyl-Fused, Spirobiindane-Derived, Phosphine-Catalyzed Synthesis of Tricyclic γ-Lactams and Kinetic Resolution of γ-Substituted Allenoates
Mingyue Wu, Zhaobin Han, Kaizhi Li, Ji'en Wu, Kuiling Ding, Yixin Lu
J. Am. Chem. Soc., 2019, 141, 16362-16373, DOI: 10.1021/jacs.9b07418
导师介绍
卢一新
https://www.x-mol.com/university/faculty/78603
https://blog.nus.edu.sg/e0220151/home/
丁奎岭
https://www.x-mol.com/university/faculty/15586
 0
0