大分子工程由于其可调多变的性质,被广泛地运用到药物递送的领域中。然而,随着聚合物载体的发展,其生物安全问题也日益受到研究者们的关注。当用于生物体中时,聚合物材料往往存在着一些严重的问题,例如清除率低,可能引发炎症反应,以及酸性降解产物导致的局部pH值下降等。其中,聚乙二醇(PEG)作为最广泛使用的聚合物载体,高分子量的PEG虽然能提高药物的稳定性和体内的循环时间,但同时由于其不可降解的问题,导致残留物无法有效地从体内清除,会引起严重的副作用。如何构建一种安全、高效的聚合物药物载体是生物医学领域亟待解决的关键科学问题。
近日,上海交通大学的颜德岳院士(点击查看介绍)、朱新远教授(点击查看介绍)团队开发了一种简单、可降解的聚合物纳米药物DPIP,用于肿瘤的治疗(图1)。DPIP由低分子量的PEG和铂(IV)前药组成,并通过pH敏感的酰腙键整合到聚合物的骨架中。通过单体的简单一步缩合反应即可获得目标产物DPIP,且使用不同分子量的PEG可实现对DPIP分子量的调控。由于PEG的亲水性和铂(IV)前药的疏水性,这种两亲性的DPIP在水中自组装形成稳定的纳米颗粒。在降解之前,DPIP保留了高分子量PEG独特的“隐身”特性。在其降解后,所生成的低分子量的PEG会被肾脏清除,从而降低聚合物载体的副作用。
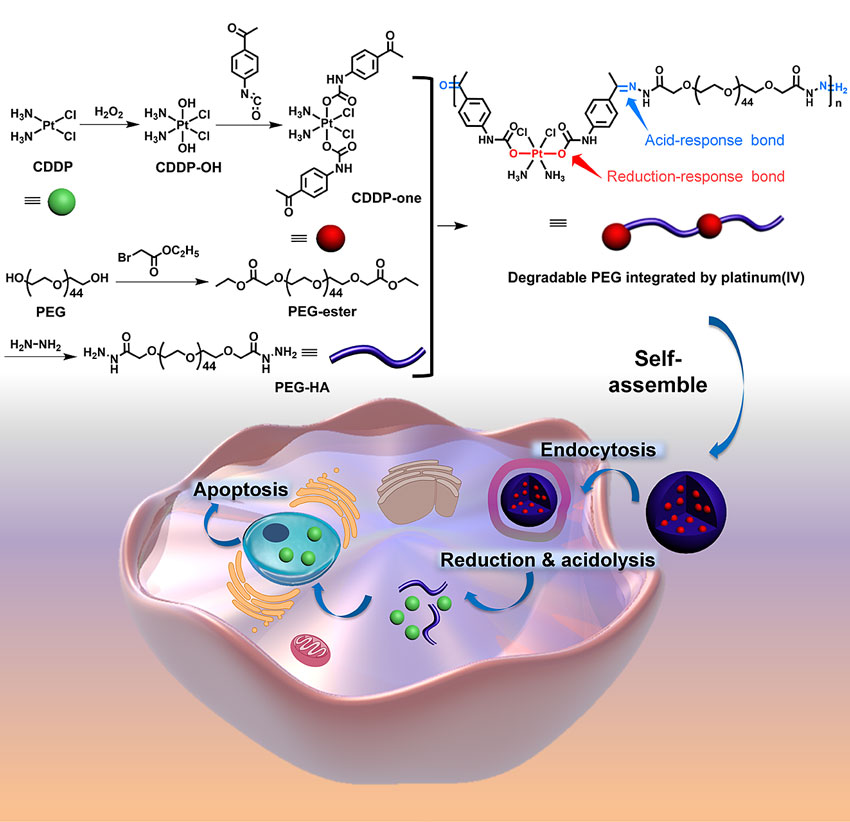
图1. 内嵌铂(IV)的可降解PEG用于肿瘤的治疗。图片来源:Matter
研究发现,该聚合物纳米药物在生理环境下稳定存在,几乎不降解。而在酸性及还原的环境下,DPIP可以成功地降解为低分子量的PEG,且快速释放药物(图2)。研究者们通过循环伏安法测试了顺铂前药的还原电势在-600 mV,和其他的Pt(IV)/Pt(II)还原对具有相类似的还原电势,表明顺铂前药可以在细胞中被还原。体外的细胞实验显示,DPIP可通过内吞作用被细胞有效摄取。对于普通的肿瘤细胞系而言,DPIP具有与顺铂相似的抑制肿瘤细胞增殖的效果。然而,当作用于耐药细胞系时,DPIP表现出优异的逆转多药耐药的能力。
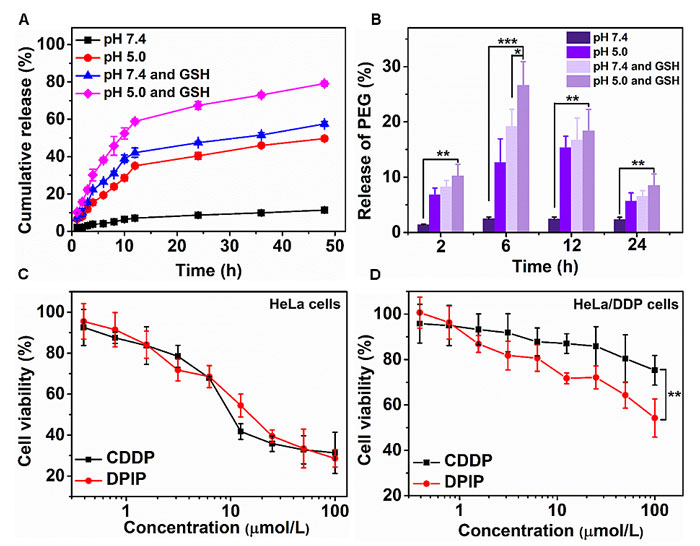
图2. 内嵌铂(IV)的可降解PEG的体外降解和细胞毒性。图片来源:Matter
该聚合物纳米药物在体内可以实现长效循环以及肿瘤富集,保留了纳米药物的特性。同时体内的聚合物降解实验,证明了DPIP可有效地被降解,且提高了肾脏对聚合物载体的清除率。在24小时内,DPIP通过尿液的总清除量达到60%,而相同分子量的PEG仅为28%(图3)。DPIP显著减轻了高分子量的PEG可能带来的副作用。此外,在皮下荷瘤鼠模型中,与对照组相比,DPIP的肿瘤抑制率达到72.7%,实现了优异的抗肿瘤效果。研究者们进一步通过病理切片和血液生化实验对DPIP的体内毒性进行了评估,结果证明,DPIP有效减轻了顺铂引起的肾毒性,且对其他组织无任何损伤。
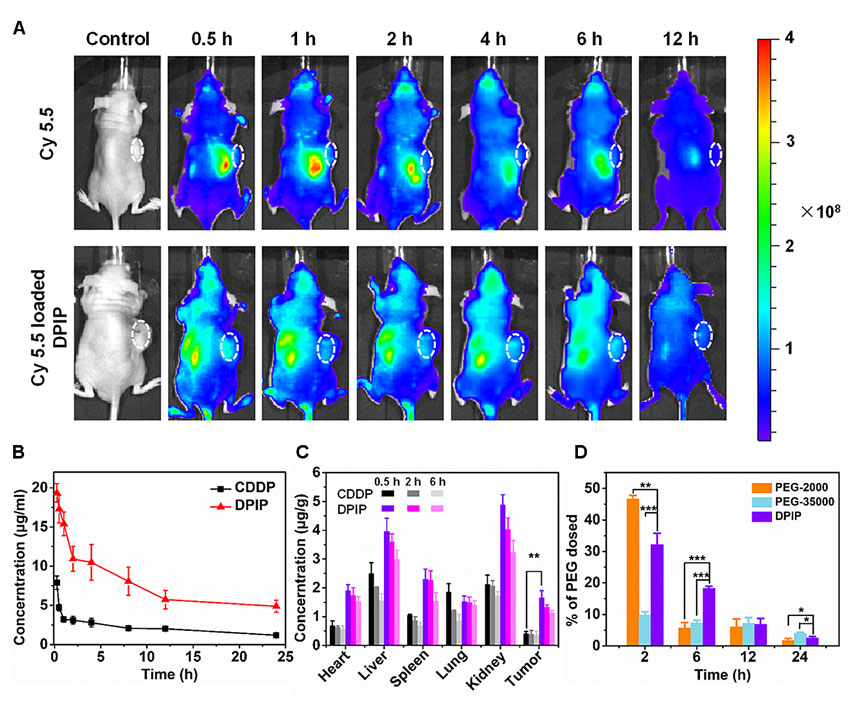
图3. 内嵌铂(IV)的可降解PEG在体内实验中的肿瘤富集及肾清除效果。图片来源:Matter
综上,内嵌铂(IV)的可降解PEG是一种安全、可调、高效的聚合物药物递送系统。该体系同时具有高分子量PEG长循环的优势,又可以在较短时间内降解成低分子量PEG,从生物体内排泄出来,降低了载体带来的副作用。该工作为药物递送系统的进一步发展提供了更多的思路。
此项研究受到国家重点研发计划、国家自然科学基金等支持,相关成果近期发表在Cell Press旗下材料学旗舰期刊Matter 上,上海交通大学博士研究生钱秋慧为第一作者,上海交通大学博士后孙默、朱新远教授、颜德岳院士为共同通讯作者。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Drug-Polymer Hybrid Macromolecular Engineering: Degradable PEG Integrated by Platinum(IV) for Cancer Therapy
Qiuhui Qian, Lijuan Zhu, Xinyuan Zhu*, Mo Sun*, Deyue Yan*
Matter, 2019, DOI: 10.1016/j.matt.2019.09.016
导师介绍
颜德岳
https://www.x-mol.com/university/faculty/12532
朱新远
https://www.x-mol.com/university/faculty/12602
(本稿件来自Matter)
 0
0