颅脑损伤 (Traumatic brain injury, TBI) 是最为常见的由意外损伤导致的急性病症, 其继发性伤害包括血脑屏障 (the blood brain barrier, BBB) 破坏、脑缺血、脑卒中等,会导致极高的死亡率及致残率。由于这些病变过程具有隐秘性,因此如何实现早期实时的TBI检测进而合理有效指导干预,对于临床TBI的治疗具有重要意义。由于现有的TBI检测方法如磁共振、CT-主要针对的是宏观的脑结构及功能的改变,无法实现TBI早期分子细胞水平的病变检测;BBB分子标记物 (如GFAP和UCH-L1) 及脑脊液 (如Acetylcholine) 也可用于体外诊断TBI,但静态有限的样品获取无法获得完整的TBI病程进展。因此,发展新型可视化技术实现原位实时高灵敏TBI早期诊断及治疗效果评估具有重大临床应用价值。
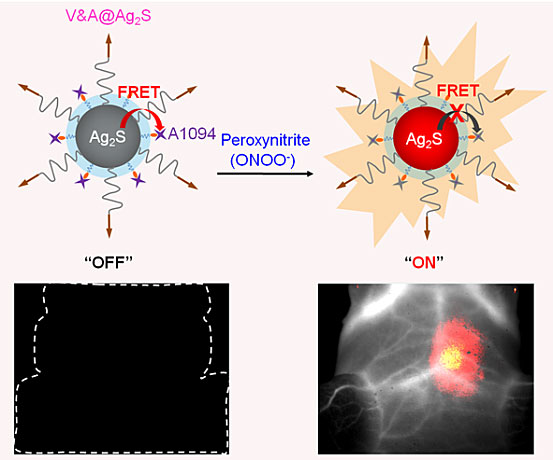
近红外II区 (1000-1700 nm) 荧光影像技术由于其固有的光学成像优点,如实时、高灵敏度、高特异性以及无电离辐射等,并且克服了传统荧光 (400-950 nm) 成像面临的低组织穿透瓶颈,被视为最具前景的活体诊断方法之一。近日,中国科学院苏州纳米技术与纳米仿生研究所王强斌(点击查看介绍)团队开发了一种靶向“激活型”近红外II区荧光纳米探针 (V&A@Ag2S),能够实现在体、实时、高灵敏TBI检测。该探针以近红外Ag2S量子点为供体,以对过氧亚硝酸根 (ONOO-) 敏感的近红外吸收染料A1094为受体,构建了基于FRET原理的淬灭型荧光传感体系。V&A@Ag2S经静脉注射后,Ag2S量子点表面修饰的VCAM-1分子介导细胞内吞过程,实现其在高效炎症性脑血管内皮细胞的内在化蓄积。同时源于上述炎症性血管内皮细胞产生的ONOO-作为TBI早期标志物,可迅速氧化A1094,从而抑制了FRET过程,导致Ag2S量子点近红外II区荧光的快速恢复,实现实时、原位、高灵敏TBI的活体检测。该靶向、“激活型”策略可以有效克服非特异性荧光信号的干扰,结合近红外 II 区荧光高组织穿透深度、高时空分辨率特性,显著提高检测的灵敏度和信噪比,可实现快速诊断,为临床TBI的诊断及治疗评估提供了新思路。
相关工作发表近期发表在Angew. Chem. Int. Ed.上。该项研究得到国家自然科学基金重点项目、科技部国家重点基础研究发展计划和中国科学院0到1突破项目等资助。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

An Activatable NIR-II Nanoprobe for In Vivo Early Real-Time Diagnosis of Traumatic Brain Injury
Chunyan Li, Wanfei Li, Huanhuan Liu, Yejun Zhang, Guangcun Chen, Zijing Li, Qiangbin Wang
Angew. Chem. Int. Ed., 2019, DOI: 10.1002/anie.201911803
导师介绍
王强斌
https://www.x-mol.com/university/faculty/23252
(本稿件来自Wiley)
 0
0












