小分子化学交联剂结合现代化的交联质谱技术是一种新兴的研究蛋白-蛋白以及蛋白-核酸大分子复合体的有力手段。目前常用的小分子交联剂主要与目标蛋白Lys氨基酸残基反应,并且不具有时空分辨率。发展小分子交联剂能够特异性与多个氨基酸残基进行交联并具有时空分辨率能够极大促进蛋白质相互作用的研究。
近日,加州大学旧金山分校王磊教授(点击查看介绍)团队合成了一系列带有光保护的醌甲基化物(QM)小分子化学交联剂。使用这些交联剂,可以通过远紫外光(365 nm)诱导从而特异性的释放活化的醌甲基化物进行蛋白质-蛋白质以及蛋白质-核酸之间的交联。这种策略不仅能够使得蛋白交联获得时间分辨率,引入的强活性的醌甲基化物可与许多邻近的亲核性的残基,如 His、Lys、Tyr 等侧链反应而产生蛋白交联。并且这些交联剂不仅使适用单个蛋白的交联,也可以在细胞裂解液以及在活体细胞中诱导蛋白-蛋白发生化学交联。
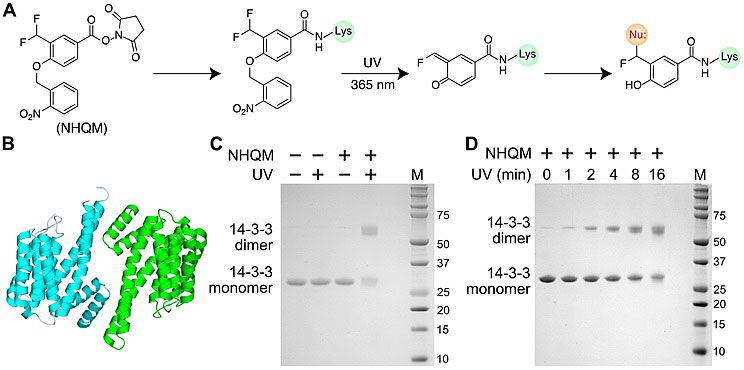
作者首先合成一端带有醌甲基化物前体,另一端带有NHS酯基的小分子化学交联剂(NHQM)。通过对14-3-3 目标蛋白紫外光照射与否以及加不加NHQM交联剂处理,作者发现只有在加入NHQM交联剂并且紫外光照射下才会诱导产生14-3-3二聚体。并且这种二聚体的产生可以很好的通过光控实时的产生。作者进一步证明了NHQM交联剂的其中一个实用性-可以快速鉴别蛋白聚合情况,并且利用化学交联质谱鉴别了在14-3-3蛋白上与醌甲基化物反应的亲和性残基。与文献报道的醌甲基化物的强活性一致,NHQM 可以与大多数亲和性残基发生反应,包括之前没有报道过的Gln、Arg、Asn弱的亲核基团发生交联。
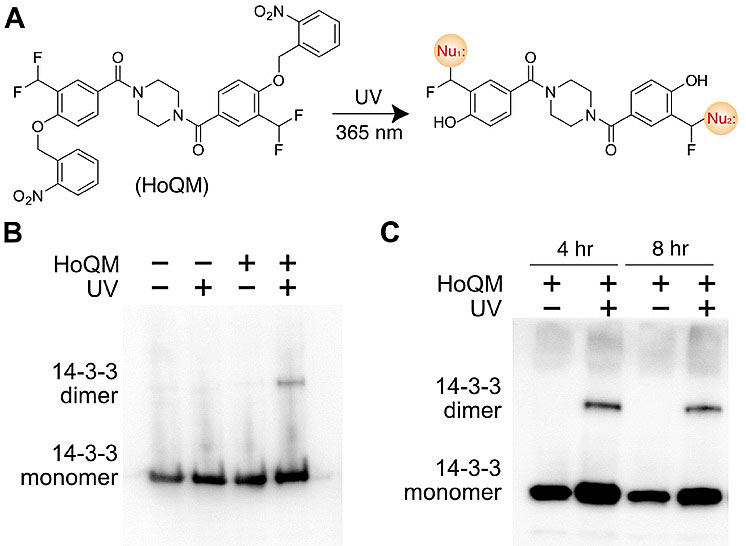
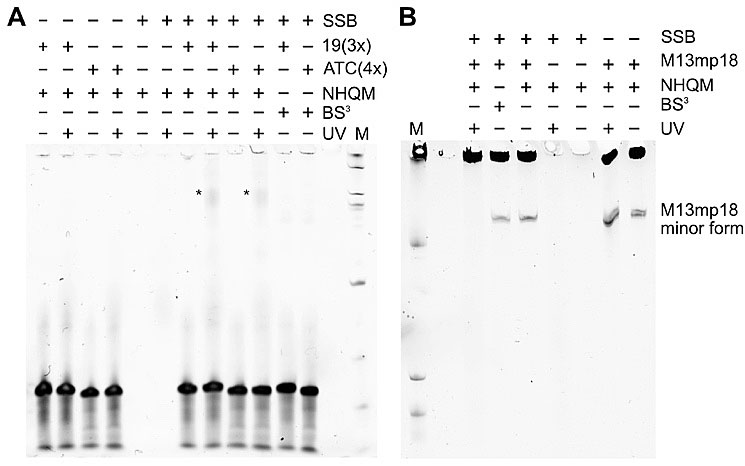
接着,作者测试了NHQM在活体细胞内的交联情况,发现细胞体内交联效率较弱,这可能与短时间内NHQM穿膜性和溶解性差有关,而增长穿膜时间NHS会快速水解从而使交联失效。为了解决这一问题,作者合成了两端都带有光保护基团的醌甲基化物前体(HoQM)并并证明它可以用于细菌细胞以及哺乳动物细胞内诱导蛋白分子间交联,并且具有时间选择性。除了用于蛋白-蛋白交联,醌甲基化物可以修饰核酸,最后作者证明了NHQM交联剂也可以通过光控诱导蛋白-核酸交联。
相关论文发表于Angew. Chem. Int. Ed.。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Photocaged Quinone Methide Cross-linkers for Light-controlled Chemical Cross-linking of Protein-protein and Protein-DNA Complexes
Jun Liu, Lingchao Cai, Wei Sun, Rujin Cheng, Nanxi Wang, Ling Jin, sharon rozovsky, Ian Seiple, Lei Wang
Angew. Chem. Int. Ed., 2019, DOI: 10.1002/anie.201910135
导师介绍
王磊
https://www.x-mol.com/university/faculty/78612
https://pharm.ucsf.edu/wang/research
(本稿件来自Wiley)
 0
0