手性环丙烯因其多用途的反应活性在合成化学领域一直受到广泛关注。炔烃与重氮化合物的不对称环丙烯化反应是构建此类张力环分子的有效方法,其中末端炔烃参与的[2+1]环加成反应由Doyle、Corey、Davies等人率先发展,并取得了很大的成功。与此形成鲜明对比的是,内炔化合物由于位阻增大、活性降低等原因,其参与的催化不对称环丙烯化反应仍是该领域的一个重要挑战。到现在为止,Davies小组报道了唯一成功的例子,但需要使用Au-Ag协同催化,且底物需为donor-acceptor类型的重氮酸酯底物。此外,含氟重氮化合物近年来已发展成为构建众多氟烷基化碳环、杂环和开链分子的重要砌块,但其参与的不对称环丙烯化反应仍未见报道。
最近,天津大学马军安教授(点击查看介绍)课题组报道了Rh(II)催化内炔与二氟重氮试剂(PhSO2CF2CHN2, Ps-DFA)的环丙烯化反应,提供了一种快速、高效、高对映选择性的构建二氟甲基环丙烯的方法。该反应最优条件为使用1.5 mol%的Hashimoto [Rh2(S-TCPTTL)4]催化剂,于二氯甲烷中在-30 ℃下反应40分钟即可,且克级实验对反应结果影响不大。在最优条件下,该不对称环丙烯化反应底物适用性良好。
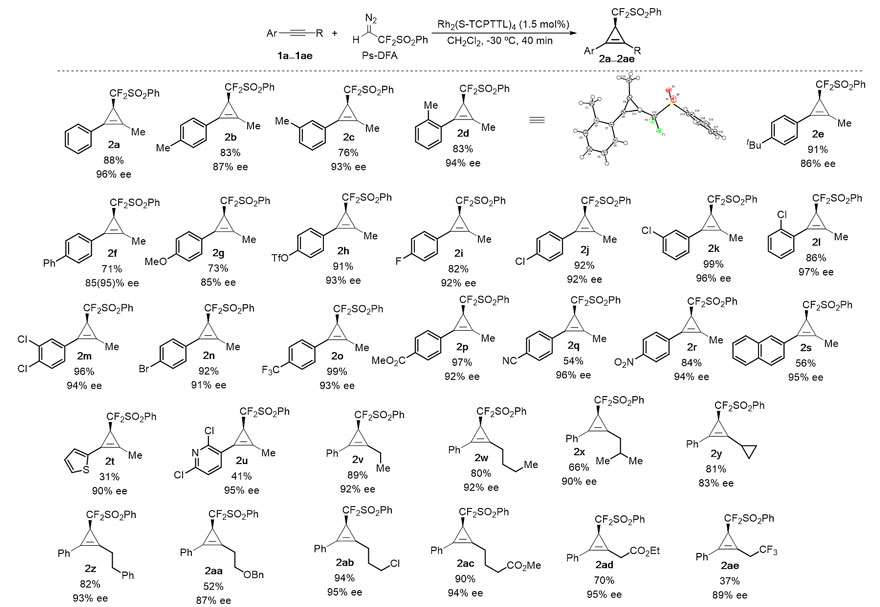
二芳基取代的内炔在该反应条件下没有转化,为解决这一限制,首先通过标准反应条件制备得到高对映选择性卤代-环丙烯(2af-2ah),随后溴代环丙烯2af通过交叉偶联反应(Suzuki与Heck),即可得到预期的手性二芳基环丙烯2ai-2ap,此类分子通过其他方法将很难合成。
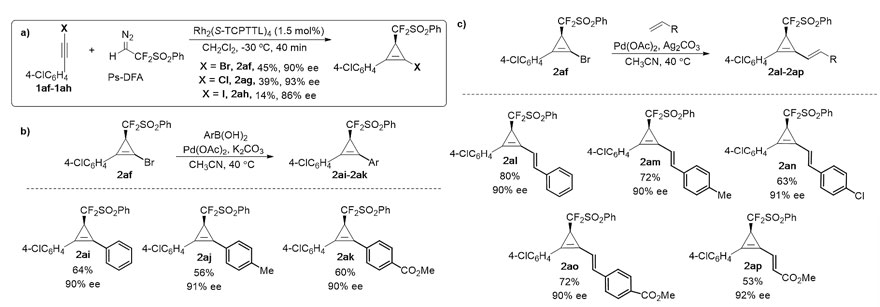
此外,所得产物可进行多种衍生转化,包括氢化、Diels-Alder反应和Pauson-Khand反应,这为一系列手性二氟甲基张力环化合物的合成提供了有效方法。

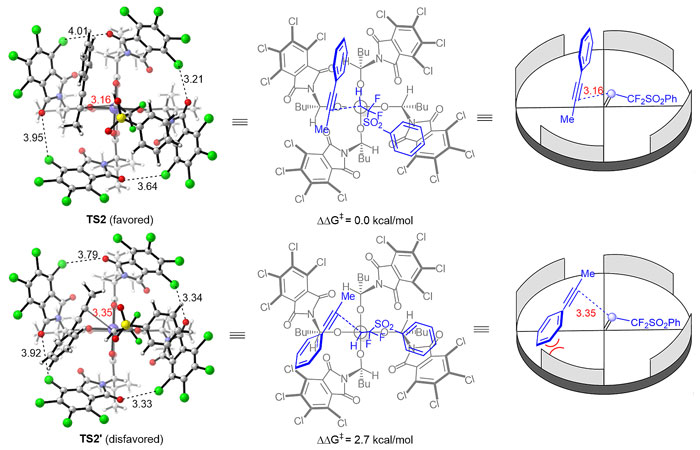
为更好地理解该反应的对映选择性控制机制,作者与南开大学薛小松老师课题组合作,使用[Rh2(S-TCPTTL)4]作为模型催化剂,运用密度泛函理论进行了详细的理论计算研究,结果显示内炔与催化剂间的立体位阻效应对立体选择性控制起到了关键作用。
相关工作发表在Angew. Chem. Int. Ed.上,第一作者是硕士研究生张志奇,该论文通讯作者是Ilan Marek教授、张发光副教授和马军安教授。该研究工作得到国家自然科学基金委 (No. 21532008, 21772142, 21901181) 和天津市科委(19JCQNJC04700) 的大力资助。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Catalytic Enantioselective Cyclopropenation of Internal Alkynes: Access to Difluoromethylated Three-Membered Carbocycles
Zhi-Qi Zhang, Meng-Meng Zheng, Xiao-Song Xue, Ilan Marek, Fa-Guang Zhang, Jun-An Ma
Angew. Chem. Int. Ed., 2019, DOI: 10.1002/anie.201911701
导师介绍
马军安
https://www.x-mol.com/university/faculty/13330
(本稿件来自Wiley)
 0
0












