手性1,4-二羰基化合物广泛存在于药物分子(比如ilomastat、batimastat、TAPI-1和BMS-906024)和天然产物(比如aspartic acid和(-)-bursehemin)中(图1)。

图1. 代表性的手性1,4-二羰基化合物。图片来源:Angew. Chem. Int. Ed.
到目前为止,构建该类1,4-二羰基化合物主要包括氧化偶联和极性反转;其中极性反转可以经由形成等价的烯醇中间体,酰基负离子中间体以及酰基自由基等方式完成。然而,构建不对称的1,4-二羰基化合物的手段还是不对称Stetter反应,一种由手性卡宾对羰基化合物极性反转后形成等价酰基负离子的对α,β-不饱和化合物进行加成的方法。而利用光催化形成酰基自由基的不对称共轭加成的方法仅在今年初由Melchiorre小组(Angew. Chem. Int. Ed., 2019, 58, 1213)和Yu小组(Org. Lett., 2019, 21, 913)利用手性胺作为手性催化剂和4-acyl-1,4-dihydropyridines (Acyl-DHPs)以及phenylgloxylic acid做为酰基自由基前体而完成。最近,新加坡国立大学的吴杰课题组和Eric Meggers教授合作报道了一例由中性曙红eosin Y和金属中心手性Rh络合物协同催化的直接从廉价易得的醛出发的高对映选择性的酰基自由基的不对称共轭加成反应(图2),利用该方法,也可取得高达99%的收率和99%的非对映选择性。
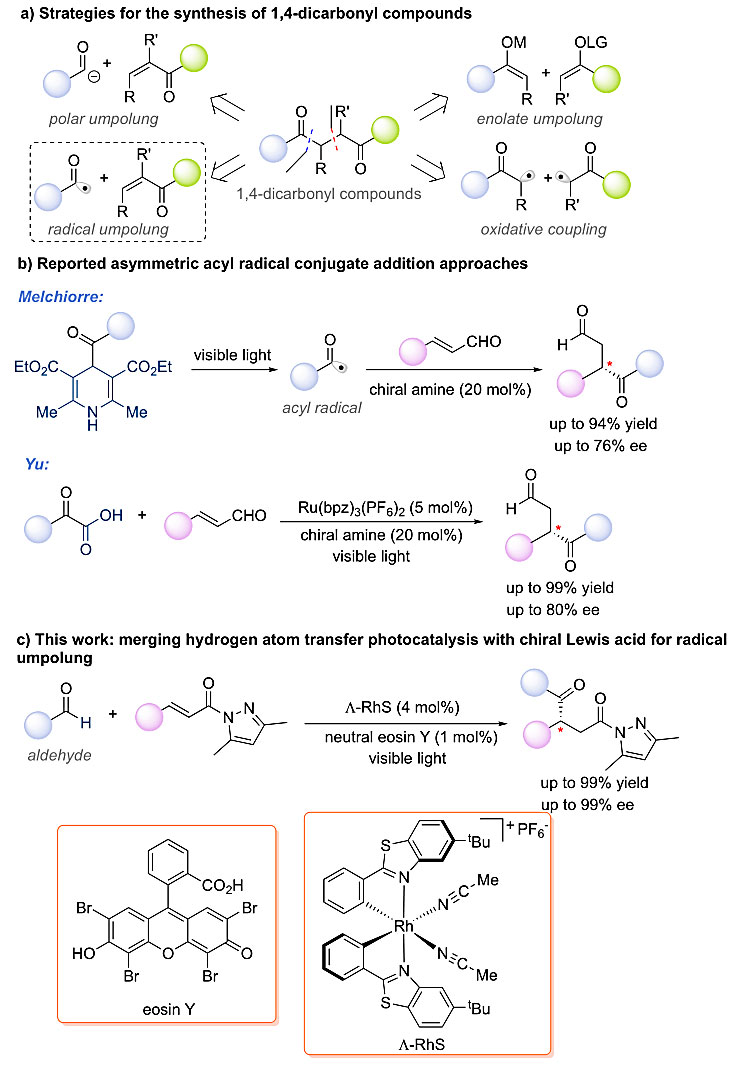
图2. 构建手性1,4-二羰基化合物合成方法。图片来源:Angew. Chem. Int. Ed.
经过条件筛选,确定了采用2:1的醛对α,β-不饱和酰胺的底物比例,1 mol%的中性署红Y,和4 mol%的Δ-RhS或者Λ-RhS用蓝光LED照射三天作为反应的最佳反应条件。在该条件下,一系列的醛类化合物,脂肪醛和芳香醛都可以取得不错的结果;同时,利用1,3-dioxolane作为反应溶剂,一系列不同取代的α,β-不饱和酰胺也都可以给出中等到优秀的反应结果。在筛选取代的α,β-不饱和酰胺时,作者也发现该反应具有较高的E式底物选择性。另外其余的HAT底物,比如醚类、胺类、亚磺酸以及二苯基氧磷等都可以取得不错的反应结果。
另外,作者进行了详细的机理研究,通过针对反应过程的UV/Vis研究证实了中性署红eosin Y是该反应主要的活性催化剂;同时对比激发态中性署红eosin Y的氧化还原电势(Es*/s-= +0.83 V vs. SCE in CH3CN/H2O),也表明了激发态的中性署红eosin Y不足以氧化醛形成酰基自由基。在另一方面,自由基抑制剂或者自由基捕获剂TEMPO的加入,反应都受到了很大的抑制;而GC-MS分析(TEMPO-COEt碎片峰)也进一步表明了酰基自由基的形成。最后,利用1H NMR也对反应的过渡态进行了研究,核磁结果表明了反应过程中加入的水并不能影响其催化反应的过渡态,并且反应的起始原料α,β-不饱和酰胺足以替换反应产物进行下一轮的催化循环。
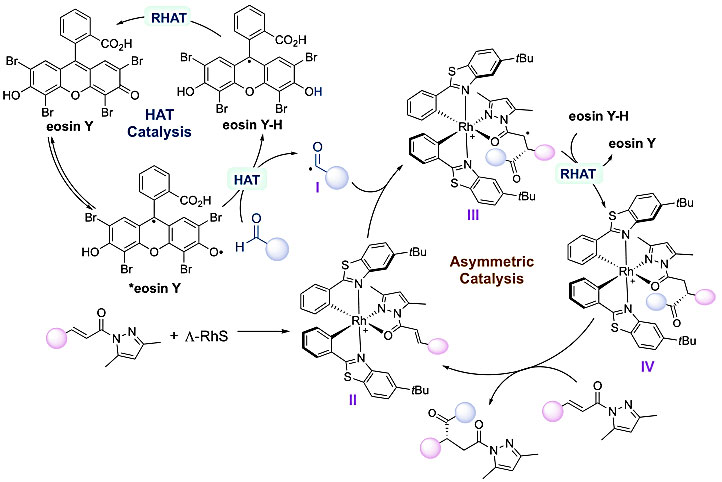
图3. 中性署红Y和手性Lewis酸协同催化不对称合成1,4-二羰基化合物的反应机理。图片来源:Angew. Chem. Int. Ed.
最终,作者提出了合理的催化循环,酰基自由基经由光激发后的eosin Y和醛通过极性匹配的HAT路径而获得。从而该酰基自由基加成到N,O-铑配位的N-酰基络合物II上并形成二级碳自由基中间体III,从而该中间体和中性eosin Y-H经逆HAT完成中性署红eosin Y的催化循环。中间体 IV和起始原料酰胺经配体交换给出最终的手性产物并再生活性络合物II。
相关成果发表在Angew. Chem. Int. Ed. 上,新加坡国立大学博士后研究员旷玉龙是本文的第一作者。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Asymmetric Synthesis of 1,4‐Dicarbonyl Compounds from Aldehydes via the Marriage of Hydrogen Atom Transfer Photocatalysis with Chiral Lewis Acid Catalysis
Yulong Kuang, Kai Wang, Xiangcheng Shi, Xiaoqiang Huang, Eric Meggers, Jie Wu
Angew. Chem. Int. Ed., 2019, 58, 16859-16863; DOI: 10.1002/anie.201910414
导师介绍
吴杰
https://www.x-mol.com/university/faculty/49776
 0
0