多环螺吲哚啉是重要的天然产物骨架。含有此类结构的化合物普遍具有抗肿瘤、抗癌等多种生物活性,并且有不少已经发展成为临床上常用的抗癌药物(比如Vinblastine、Vincristine)或候选药物。由于其结构易修饰且具有广泛的应用价值,多环螺吲哚啉一直备受合成和药物化学家们的青睐。近几十年来,合成化学家们通过不断地探索,发展了一系列构建多环螺吲哚啉的合成方法。但是,这些方法大都集中于利用复杂底物的分子内反应,通过简单底物的分子间反应来快速高效地合成此类骨架的例子还很少,尤其是在这一过程中通过利用手性催化剂实现对多个手性中心的有效控制是一个艰巨的挑战。

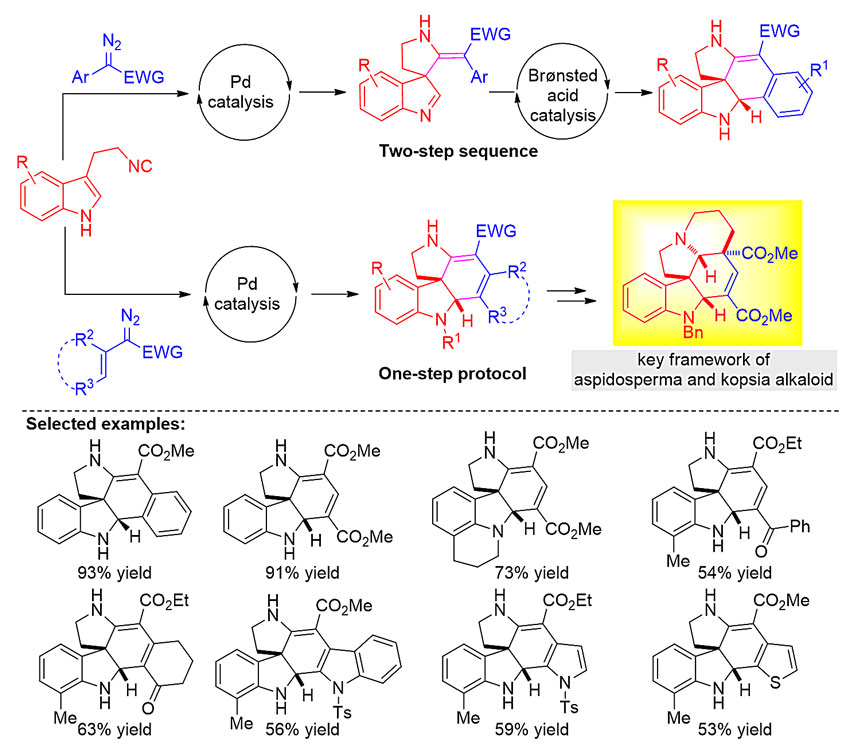
最近,广州大学化学化工学院刘运林课题组基于前期对构建螺环吲哚啉及含氟环状化合物的基础和理解(Org. Chem. Front., 2018, 5, 2303; Adv. Synth. Catal., 2018, 360, 3643; Adv. Synth. Catal., 2019, 361, 876; Adv. Synth. Catal., 2019, 361, 1408; Chem. Commun., 2019, 55, 3879),设计并实现了一例高效、高立体选择性构建具有结构多样性的多环螺吲哚啉化合物的反应。他们发现3-(2-异氰乙基)吲哚可以与重氮化合物通过交叉偶联/螺环化/Mannich-type串联反应合成含有两个连续手性中心的多环螺吲哚啉骨架。该策略对于α-烯基,α-2-萘基及α-杂芳基取代的重氮羧酸酯,反应可以在Pd(PPh3)4或Pd2(dba)3为催化剂条件下一步实现多环螺吲哚啉的合成;对于α-芳基取代的重氮底物,反应需要在Pd(PPh3)4和Brønsted酸的连续催化下通过两步反应来构建多环螺吲哚啉骨架。后续的分子内Mannich-type环化反应在以手性磷酸作为催化剂时,他们成功实现了多环螺吲哚啉的不对称合成。该方法操作简便,反应条件温和,底物普适性广,对不同取代的底物均能取得中等到优秀的产率。利用此方法,他们通过几步简单的化学转化简洁高效地完成了aspidosperma和kopsia生物碱五环核心骨架的构建,为日后这两类天然产物的全合成提供了新的研究思路与方法。此外,该策略进一步丰富了3-(2-异氰乙基)吲哚的反应模式,为多环螺吲哚啉的合成提供了新路径,产物有望在药物研发中得到应用。
这一研究成果发表于Angew. Chem. Int. Ed.上
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Tandem Cross-Coupling/Spirocyclization/Mannich-Type Reactions of 3-(2-Isocyanoethyl)indoles with Diazo Compounds toward Polycyclic Spiroindolines
Guo-Shu Chen, Shu-Jie Chen, Jian Luo, Xiang-Yu Mao, Albert Sun-Chi Chan, Raymond Wai-Yin Sun, Yun-Lin Liu
Angew. Chem. Int. Ed., 2019, DOI: 10.1002/anie.201911614
(本稿件来自Wiley)
 0
0