化学治疗是肿瘤临床治疗的策略之一,但常规药物递运模式中不可控的药物释放与泄露往往会导致严重的毒副作用。光控开关优秀的时间可控性与空间分辨率使其在载药系统中可以精准控制药物释放、有效防止对正常器官组织的损伤。将光控开关与上转换纳米粒子(UCNPs)的近红外光激活相结合,可使药物定点释放具有更深的组织穿透深度及更低的光毒性。然而,现有的光响应型药物递运模式均依赖“开-关”型响应模型,药物在细胞质中的释放依赖被动扩散过程,且受限于上转换纳米材料较低的发光能量转移效率,往往需要较长的光照时间才能使药物释放量达到治疗水平,效率不足且容易由光辐射引发组织热损伤。
针对这一瓶颈问题,南京大学生命分析化学国家重点实验室鞠熀先教授(点击查看介绍)、刘颖教授(点击查看介绍)研究团队利用偶氮苯分子修饰的DNA链,设计了一种以上转换纳米材料发光供能的偶氮苯-DNA纳米泵,变“开-关”型释药模式为“分子泵”型释药模式,大幅提高了光控药物释放效率。该工作将偶氮苯修饰的DNA链组装在UCNPs表面,并利用DNA链的双螺旋结构负载抗癌药物阿霉素(DOX),同时进一步在纳米材料外层包覆透明质酸以实现对癌细胞的靶向(图1a)。柔性的DNA链在UCNPs表面的紧密包裹能够有效提高偶氮苯-DNA纳米泵对UCNPs发射光的利用率。在980 nm激光照射下,UCNPs同时发射出紫外光和可见光,促使偶氮苯分子发生连续的光异构化,进而驱动DNA链的杂交和去杂交,而旋转运动的偶氮苯分子就像一个个叶轮泵,促使药物释放,从而实现近红外光激活的药物高效释放,在光照30 min后药物释放率达到86.7%(图2a, UCNPs-DNA-Azo/DOX)。同时,由于DOX的作用场所在细胞核中,为防止细胞质中高浓度药物被细胞膜上转运蛋白(如P糖蛋白)外排,肽链HIV-1 TAT被偶联到偶氮苯-DNA纳米泵表面以实现细胞核靶向(图1b),从而有效提高了DOX在癌细胞核区域的聚集,增强了对于癌细胞的治疗效果,对癌细胞增殖的抑制率达到70%以上(图2b, UCNPs-DNA-Azo/DOX-TAT-HA),并在活体实验中显示对实体瘤生长的有效抑制,为高效可控的药物释放与治疗开发了普适通用的平台。
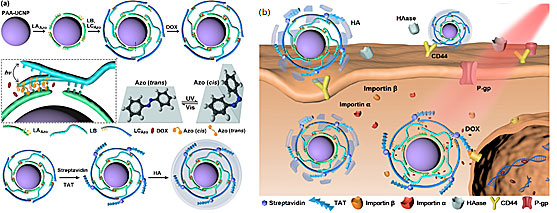
图1. (a) 偶氮苯-DNA纳米泵的合成及(b)HA介导的细胞内吞、TAT介导的细胞核靶向和近红外光激发的药物释放示意图。
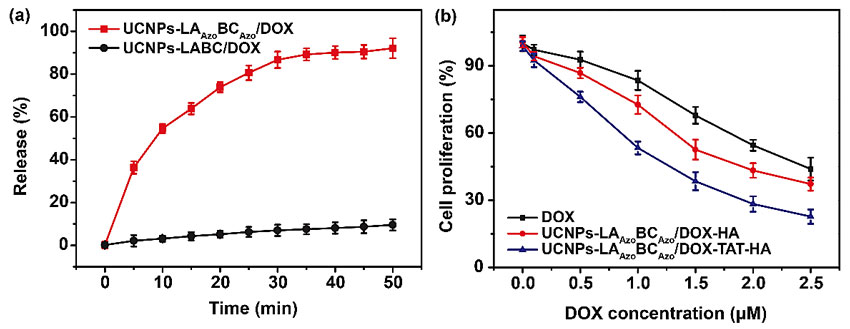
图2. (a) 近红外光照0-50分钟后UCNPs-DNA-Azo/DOX以及UCNPs-DNA/DOX中DOX的释放率。(b) 不同浓度的DOX,UCNPs-DNA-Azo/DOX-HA以及UCNPs-DNA-Azo/DOX-TAT-HA处理并近红外光照30分钟后HepG2细胞相对增殖率。
上述成果于近期在Angew. Chem. Int. Ed. 发表。博士生张玥为第一作者,鞠熀先教授和刘颖教授为共同通讯作者。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

A DNA–Azobenzene Nanopump Fueled by Upconversion Luminescence for Controllable Intracellular Drug Release
Yue Zhang, Yue Zhang, Guobin Song, Yuling He, Xiaobo Zhang, Ying Liu, Huangxian Ju
Angew. Chem. Int. Ed., 2019, DOI: 10.1002/anie.201909870
导师介绍
鞠熀先
https://www.x-mol.com/university/faculty/11571
刘颖
https://www.x-mol.com/university/faculty/22031
 0
0









