含氮杂环化合物广泛存在于天然产物和药物分子中,其高效构建对于药物研发具有重要意义,一直是合成化学的热点研究领域。基于亚胺C=N双键的转化是构建含氮杂环的基本策略之一。基于此,尽管已发展了杂Diels-Alder、Povarov、1,3-偶极环加成反应以及串联合成等方法,但发展多样性合成含氮杂环的新方法依然是研究趣向。
近日,华东师范大学周剑教授(点击查看介绍)团队发展了通过调控亚胺分子内亲核加成反应的区域选择性来多样性构建含氮杂环的方法。对亚胺的亲核加成往往发生在带部分正电荷的C端,要实现对N端的亲核加成,则需亚胺碳上具有拉电子取代基来稳定过渡态中产生的负电荷。对亚胺N端的分子间亲核加成反应已有一定进展,但主要利用格式试剂等金属试剂与非环状活泼亚胺反应来制备氨基酸衍生物等,尚未用于含氮杂环化合物的合成。作者认为,若能发展分子内的对亚胺C端或N端的区域选择性亲核加成反应,将为含氮杂环的多样性构建提供一个新策略,因为改变亚胺结构、亲核试剂种类和链接基团均将导向不同的含氮杂环化合物。他们首先尝试在亚胺氮上链接硝基烷烃作为亲核试剂来研究这一设想。经条件优化,发现从靛红和2-(2-硝基乙基)苯胺衍生的亚胺出发,在无机碱/甲醇体系下,主要发生对亚胺N端的亲核加成反应,以95%的产率得到吲哚化合物;而使用手性铜催化剂,则专一地发生对C端的加成,以高产率和er值得到手性氧化吲哚螺四氢喹啉化合物。
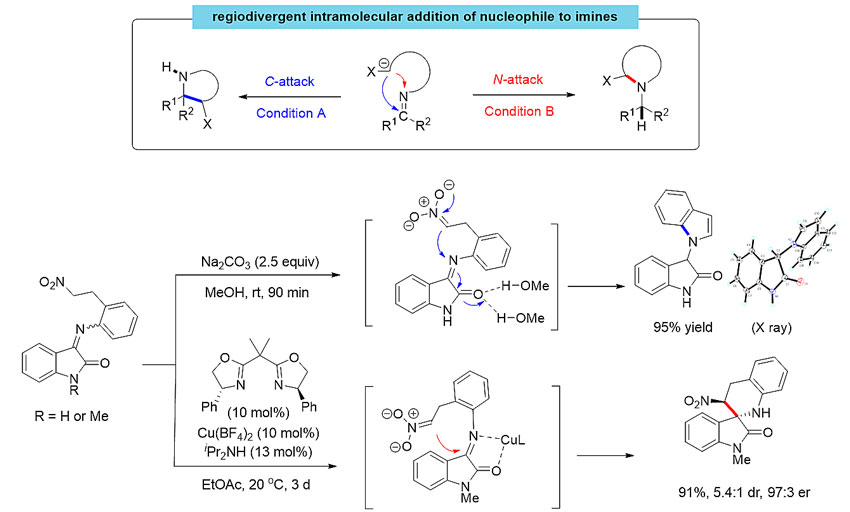
图1. 亚胺分子内亲核加成反应的区域选择性调控
通过与四川大学王欣教授(点击查看介绍)合作进行理论计算研究发现,吲哚产物的生成是通过N-亲核加成和硝基的消除来实现,而甲醇和底物以及反应中间体之间的O-H∙∙∙O氢键相互作用起了关键作用。这种作用强于O-H∙∙∙N作用,使得N-亲核加成反应的过渡态能量要低于C-亲核加成。另外,N-亲核加成反应中间体要比C-亲核加成反应的更稳定,对亚胺N端的反应是热力学自发的过程。
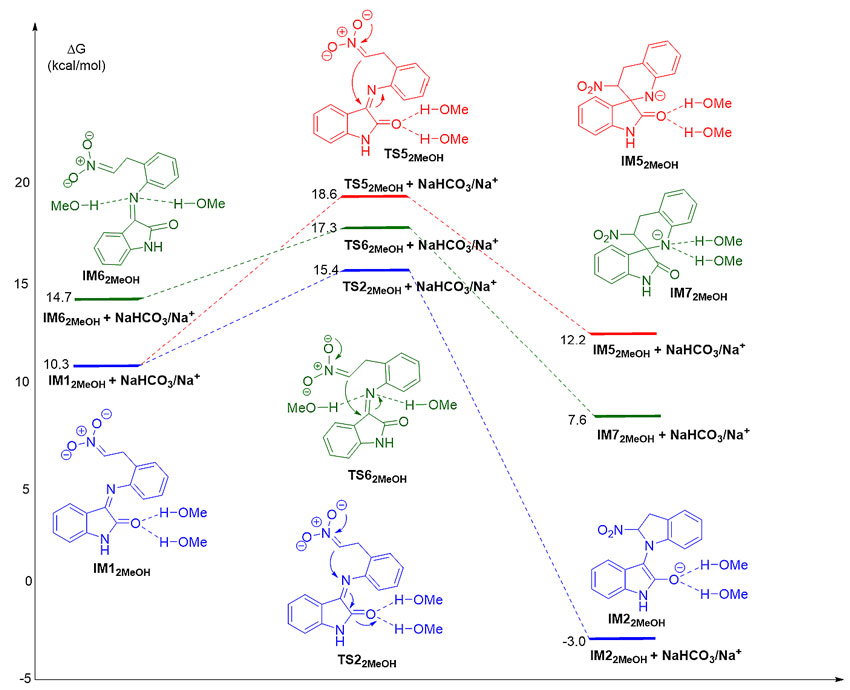
图2. 机理研究
利用该方法,可从靛红和2-(2-硝基乙基)苯胺出发,通过一锅法串联反应方便合成系列3-吲哚基取代的氧化吲哚,或高产率和立体选择性得到螺四氢喹啉化合物。α-酮酸酯衍生的亚胺同样能区域选择性生成吲哚衍生物,或在手性相转移催化条件下发生C-亲核加成生成手性四氢喹啉化合物。
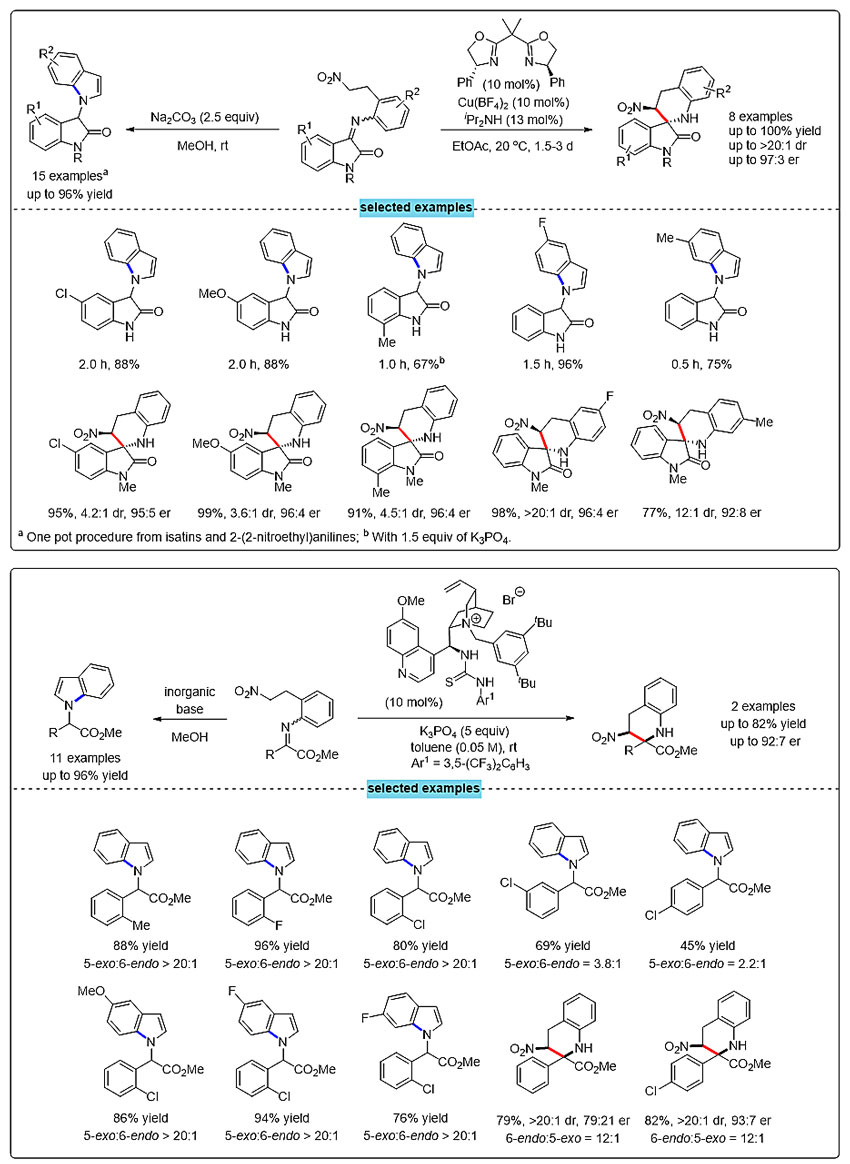
图3. 底物拓展
所得N-官能团化的吲哚化合物具有重要合成用途。如利用不对称Michael加成反应作为关键步骤,实现了天然产物(-)-Psychotrimine的形式合成。此外,还可合成多种复杂含氮杂环化合物。
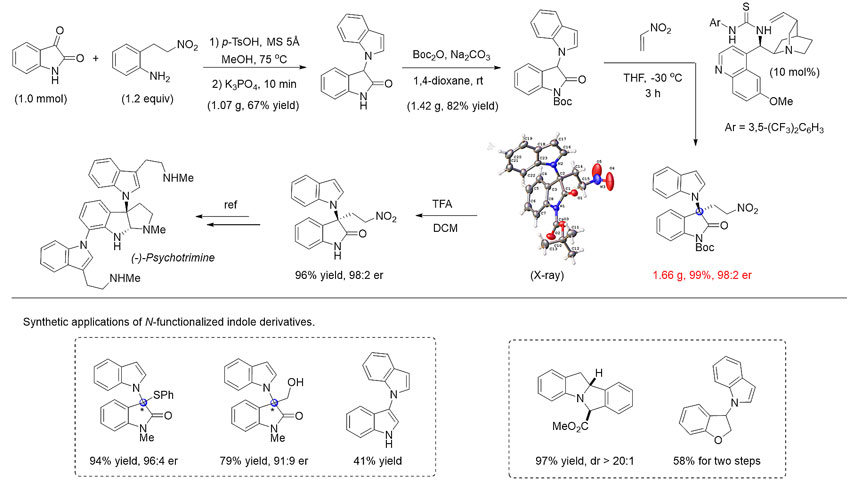
图4. 产物转化
相关工作发表在Angew. Chem. Int. Ed.上。文章的第一作者是王雨卉博士。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Regiodivergent Intramolecular Nucleophilic Addition of Ketimines for the Diverse Synthesis of Azacycles
Yu-Hui Wang, Jun-Song Tian, Peng-Wei Tan, Qiang Cao, Xue-Xin Zhang, Zhong-Yan Cao, Feng Zhou, Xin Wang,* Jian Zhou*
Angew. Chem. Int. Ed., 2019, DOI: 10.1002/anie.201910864
导师介绍
周剑
https://www.x-mol.com/university/faculty/10524
王欣
https://www.x-mol.com/university/faculty/12815
(本稿件来自Wiley)
 0
0












