英文原题:Pseudoneutrophil Cytokine Sponges Disrupt Myeloid Expansion and Tumor Trafficking to Improve Cancer Immunotherapy
通讯作者:王育才,中国科学技术大学
作者:Shuya Li, Qin Wang, Yanqiong Shen, Muhammad Hassan, Jizhou Shen, Wei Jiang, Yitan Su, Jing Chen, Li Bai, Wenchao Zhou, Yucai Wang*
髓系抑制性细胞(MDSCs)是一群髓系来源具有抑制功能的天然免疫细胞。这类细胞是肿瘤免疫抑制微环境的主要诱因之一,不仅抑制T淋巴细胞介导的抗肿瘤免疫反应,还会直接促进肿瘤的生长和转移。多种细胞因子与其受体联合作用诱导了MDSCs的扩增、募集和活化。阻断单一特异性受体或细胞因子效果有限,并且会导致代偿性的募集可替代的免疫抑制细胞群。
为解决上述问题,中国科学技术大学王育才教授(点击查看介绍)团队设计了一种仿生纳米粒子,不仅能够有效的抑制MDSCs的扩增、募集、活化,并且能避免机体代偿作用,从而有效的缓解免疫抑制微环境,增强α-PD-1的抗肿瘤治疗效果。如图1所示,该仿生纳米粒子是以可降解高分子聚合物纳米颗粒poly(lactic-co-glycolic acid) polymeric nanoparticles (PLGA NPs)为内核,并以活化的中性粒细胞细胞膜为外壳。仿生纳米粒子继承了中性粒细胞细胞膜表面的膜受体,并赋予了它吸附细胞因子和粘附血管的能力。这种仿生纳米粒子可抑制肿瘤导致的MDSCs的三种效应:(1)在骨髓中的扩增;(2)向外周淋巴器官的和肿瘤组织的募集;(3)在肿瘤组织中的活化。
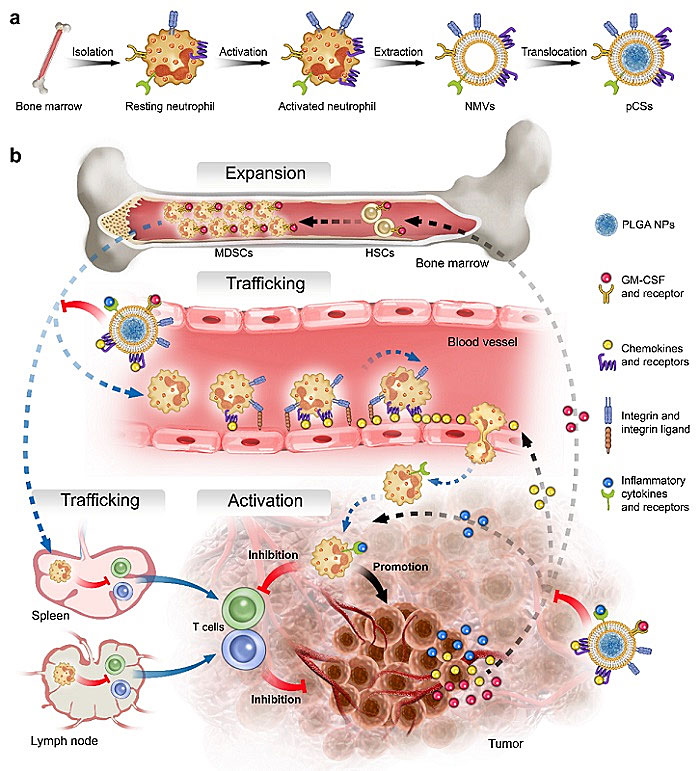
图1. 仿生纳米粒子抑制MDSCs扩增、募集和活化示意图。
该团队首先证明了肿瘤组织释放的细胞因子使MDSCs扩增和肿瘤募集增加,降低T淋巴细胞的数量,限制α-PD-1的抗肿瘤治疗效果。透射电子显微镜和动态光闪射证明仿生纳米粒子的成功制备,此外仿生纳米粒子继承了中性粒细胞细胞膜表面的受体并且这些受体具有正确的蛋白质取向,在体内外都能够有效的吸附MDSCs相关的细胞因子(图2)。
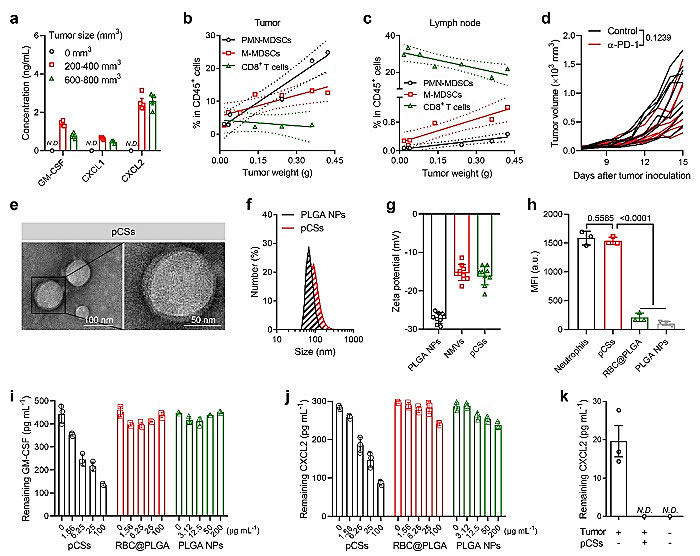
图2. 仿生纳米粒子有效吸附MDSCs相关的细胞因子:(a)肿瘤组织血液中GM-CSF、CXCL1、CXCL2的表达水平;(b,c)PMN-MDSCs,M-MDSCs,CD8+T在肿瘤和淋巴器官中比例;(d)肿瘤生长曲线;(e)透射电子显微镜图像;(f)粒径分布;(g)电势;(h)CXCL2的表达;(i,j)GM-CSF和CXCL2的体外吸附实验;(k)CXCL2体内吸附实验。
该团队利用黑色素瘤(B16F10)和乳腺癌(4T1)荷瘤小鼠模型研究了仿生纳米粒子对MDSCs的扩增和募集的抑制效果。评估了仿生纳米粒子治疗后PMN-MDSCs和M-MDSCs在肿瘤和外周淋巴器官的比例变化(图3)。证明了肿瘤的存在增加了PMN-MDSCs的扩增和募集,仿生纳米粒子的治疗抑制PMN-MDSCs增加并使其接近于正常状态下机体水平。仿生纳米粒子的治疗也能抑制M-MDSCs的募集,并且避免了代偿性M-MDSCs肿瘤募集。与此同时,活体显微成像炎症状态下的肿瘤组织血管,进一步证明了仿生纳米粒子能够通过吸附细胞因子和粘附血管来抑制MDSCs的肿瘤浸润(图4)。
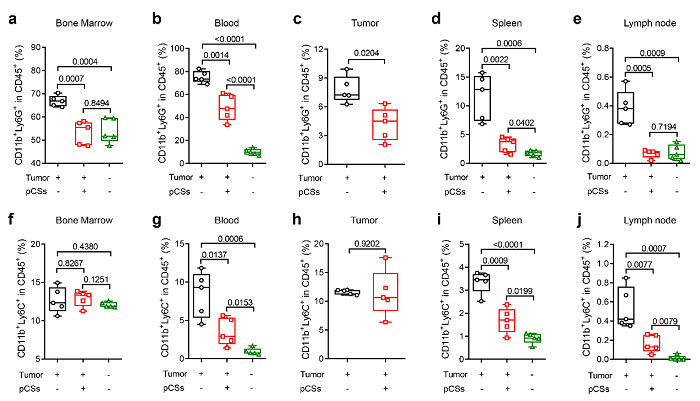
图3. 仿生纳米粒子有效抑制MDSCs的骨髓扩增、肿瘤和外周淋巴器官募集:(a-e)PMN-MDSCs(CD11b+Ly6G+)和(f-g)M-MDSCs(CD11b+Ly6C+)在骨髓、血液、肿瘤、脾脏和淋巴结中的比例变化。
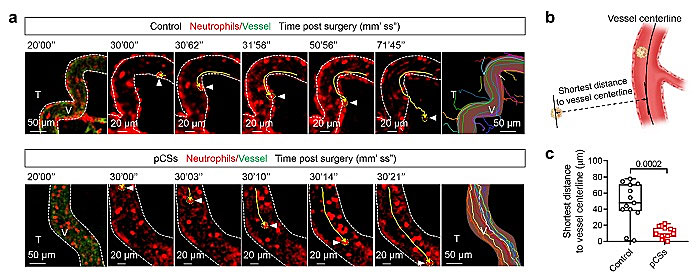
图4. 仿生纳米粒子降低了中性粒细胞的血管粘附和肿瘤募集:(a)中性粒细胞的炎症趋化过程;(b-c)中性粒细胞到血管中线最短距离的示意图和相关统计。
该团队进一步在黑色素瘤和乳腺癌两种肿瘤模型中证明了仿生纳米粒子在免疫健全小鼠模型中显著的抑制肿瘤的生长,然而在免疫缺陷小鼠模型中对肿瘤治疗无效(图5)。说明了仿生纳米粒子的抗肿瘤治疗效果是免疫系统依赖的。团队同时验证了仿生纳米粒子有效的提高T细胞在肿瘤中的数量及功能(图6)。
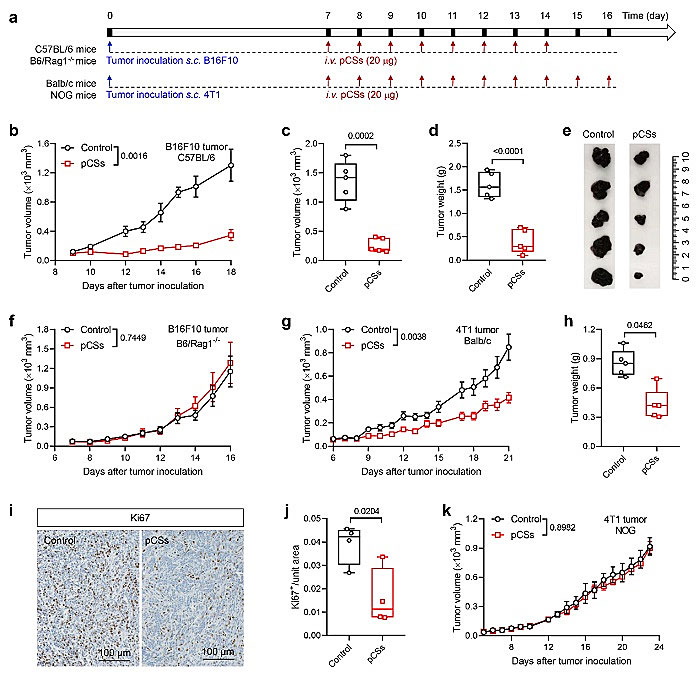
图5. 仿生纳米粒子对黑色素瘤和乳腺癌的生长抑制作用依赖于完整的免疫系统:(a)仿生纳米粒子治疗方案示意图;(b-f)仿生纳米粒子在(b-e)免疫健全(C57BL/6)和(f)免疫缺陷(B6/Rag-1-)小鼠中对黑色素瘤治疗效果;(g-k)仿生纳米粒子在(g-j)免疫健全(BALB/c)和(k)免疫缺陷(NOG)小鼠中对乳腺癌的治疗效果。
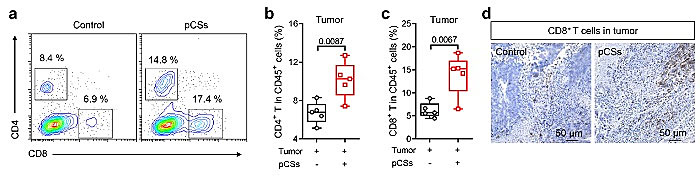
图6. 仿生纳米粒子增加T淋巴细胞的肿瘤富集并增强其功能:(a-d)CD4+T细胞和CD8+T细胞在肿瘤中的数量变化。
该团队通过仿生纳米粒子与免疫检查点抑制剂α-PD-1联合治疗,最终证明仿生纳米粒子对肿瘤免疫抑制微环境的缓解显著增强了免疫检查点抑制剂的治疗效果并延长了荷瘤小鼠的存活时间(图7)。
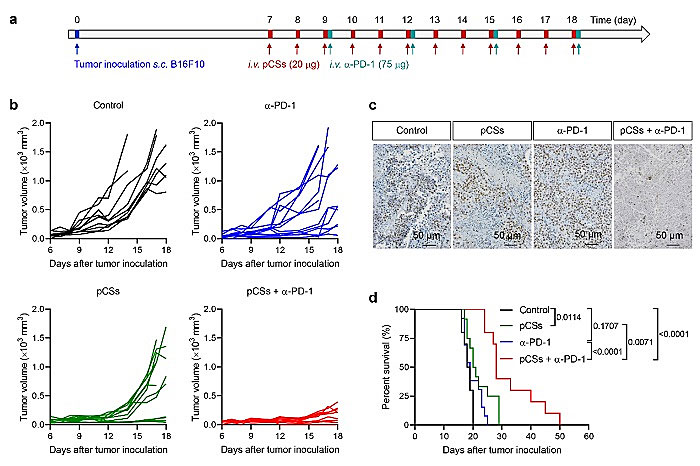
图7. 仿生纳米粒子联合α-PD-1治疗延长荷瘤小鼠生存时间。
最后,该团队设计了一个仿生纳米海绵,通过对细胞因子的吸附限制了髓系抑制性细胞的数量和抑制性功能,有望于克服目前临床上针对免疫治疗耐药性策略上的限制。
这一成果近期发表在Nano Letters 上,中国科学技术大学博士研究生李舒雅为文章第一作者,王育才教授为通讯作者。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Pseudoneutrophil Cytokine Sponges Disrupt Myeloid Expansion and Tumor Trafficking to Improve Cancer Immunotherapy
Nano Lett., 2019, DOI: 10.1021/acs.nanolett.9b03753
Publication Date: December 2, 2019
Copyright © 2019 American Chemical Society
通讯作者介绍

王育才,男,中国科学技术大学教授,博士生导师。2005年于中国科学技术大学获得学士学位;2010年于中国科学技术大学获得博士学位;2011年1月起先后于圣路易斯华盛顿大学生物医学工程系、佐治亚理工学院生物医学工程系及芝加哥大学James Franck研究所从事博士后研究。2015年回到中国科学技术大学生命科学学院任教,主持或参与科技部重点研发、基金委重点项目、面上项目等。多年来一直从事纳米材料在癌症治疗及成像领域的研究,在Nat Mater、Nat Commun、PNAS、Nano Letters、ACS Nano 国际学术期刊发表研究论文70余篇,引用次数超过5000次,H-index 为39。
https://www.x-mol.com/university/faculty/62205
(本稿件来自ACS Publications)
 0
0











