近日,西南大学袁若教授(点击查看介绍)课题组在电致化学发光高通量生物传感方面取得进展,相关研究成果发表在Analytical Chemistry 上。
电致化学发光(ECL)作为一种可控、灵敏的分析方法为疾病标志物的高通量灵敏检测提供了可行性平台。由于双ECL信号物质之间会产生交叉反应,使得基于双ECL信号物质构建的双目标物检测出现了不可避免的原理性误差。
在前期工作中,袁若课题组通过可控的金属纳米簇制备方法结合共反应促进剂催化途径,提高了金属纳米簇的ECL发光效率,为金属纳米簇在生物传感和成像方面的发展奠定了研究基础(Anal. Chem., 2017, 89, 3732-3738; Anal. Chem., 2017, 89, 6787-6793; Anal. Chem., 2018, 90, 10024-10030)。在此基础上,他们进一步采用了金纳米簇(Au NCs)作为单一的ECL信号物质,通过阴极和阳极的共反应促进剂ECL催化路径,同时激发Au NCs的双极ECL发光。为了达到双组分灵敏检测的要求,二氧化钛纳米片(TiO2 NSs)为阴极共反应促进剂催化共反应试剂溶解氧的还原从而促进Au NCs在-1.5到0.0 V产生阴极ECL响应,同时氧化亚铜@铜纳米粒子(Cu2O@Cu NPs)为阳极共反应促进剂加速共反应试剂N,N-二甲基乙二胺(DEDA)的氧化从而促进Au NCs在0.0到1.2 V产生阳极ECL响应。因此,阴极ECL探针(Au NCs-TiO2 NSs/O2)和阳极ECL探针(Au NCs-Cu2O@Cu NPs-DEDA)之间有约为2.7 V的显著峰值电位差,为单界面上实现电压分辨双目标物检测奠定了坚实的基础。借由Au NCs阴阳极的显著ECL响应同时实现癌胚抗原(CEA)和黏蛋白1(MUC1)的灵敏、准确检测,其检测限分别为0.43 pg/mL及5.8 fg/mL。本研究巧妙地利用金属纳米簇的双极ECL响应的特性解决了ECL双组分同时检测的难题,为贵金属纳米簇在高灵敏、高通量生物传感器的发展开辟了新方向。
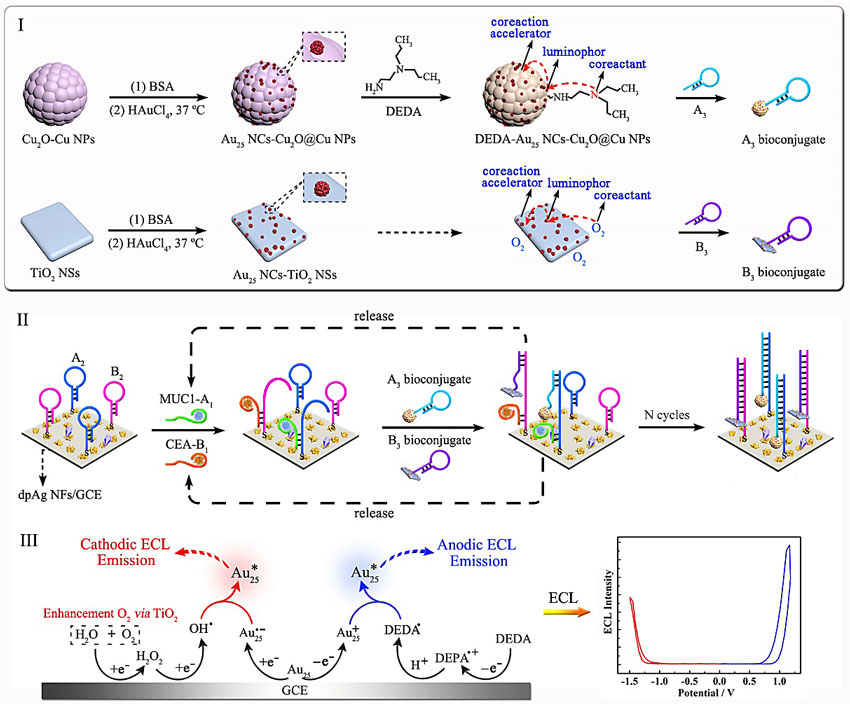
Scheme 1. 适体传感器的构建过程:(I)A3生物复合物(A3/Au NCs-Cu2O@Cu NPs-DEDA)和B3生物复合物(B3/Au NCs-TiO2 NSs)的制备过程,(II)适体传感器用于MUC1及CEA双目标物的检测原理,(III)单界面上Au NCs协同阴、阳极的ECL发光机理。
文章的第一作者为西南大学化学化工学院的博士研究生周莹,西南大学化学化工学院的柴雅琴教授和袁若教授为共同通讯作者。相关研究工作得到国家自然科学基金委的支持。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Highly Efficient Dual-Polar Electrochemiluminescence from Au25 Nanoclusters: The Next Generation of Multibiomarker Detection in a Single Step
Ying Zhou, Ya-Qin Chai, Ruo Yuan
Anal. Chem., 2019, 91, 14618-14623, DOI: 10.1021/acs.analchem.9b03736
导师介绍
袁若
https://www.x-mol.com/university/faculty/13979
 0
0










