亲核性膦或胺催化的环加成反应已成为合成碳环和杂环化合物的不可或缺的方法之一,其中,联烯酸酯与亚胺之间的环化反应尤其受到广泛的关注。近二十年来,五种亚胺与联烯之间的亲核性催化反应模式被报道,从而构建不同类型和大小的含氮杂环化合物(图1)。这些反应模式共同的特点是产生了含磷两性离子中间体,并由其碳负离子启动与亚胺之间的环加成反应,而发展新反应模式和发现新反应中间体依然是这个研究领域的重点和难点,最终将进一步完善亚胺与联烯之间的环加成反应体系。
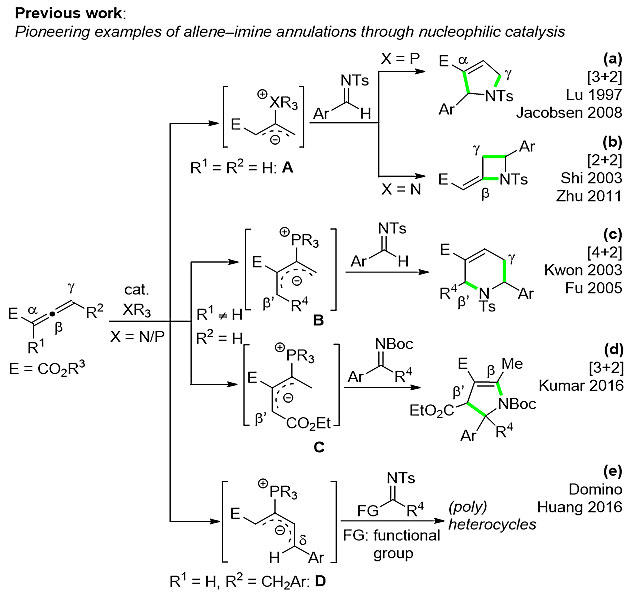
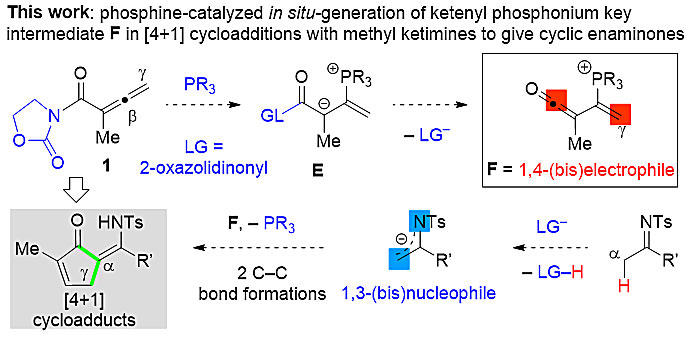
图1. 联烯与亚胺之间的亲核性催化反应模式
最近,武汉理工大学黄毅勇教授(点击查看介绍)课题组基于亚胺与联烯之间的亲核性催化反应体系只涉及两性离子反应中间体的研究现状,突破现有反应模式,创新性的提出用噁唑烷酮衍生的联烯酰亚胺替代联烯酸酯,最终在叔膦催化剂PBu3作用下实现首例联烯与不同取代的甲基亚胺和烯胺、酰胺之间的[4 + 1]环加成反应,分别构建了全取代烯胺酮、含全碳手性中心的β-酮亚胺及γ-内酰胺等重要骨架分子(图2)。
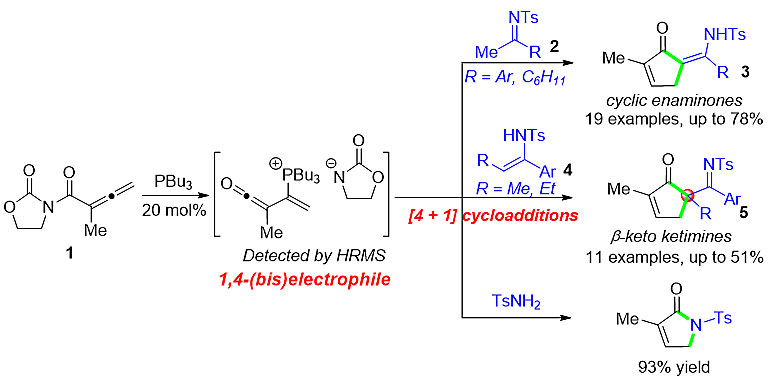
图2. 膦催化的联烯酰亚胺与亚胺、烯胺和酰胺之间的[4 + 1]环加成反应
接下来,该课题组对反应体系进行31P NMR和HRMS跟踪实验,首次监测到双亲电性α-烯酮基不饱和季鏻盐中间体,并提出了如下可能反应机理(图3):首先,PBu3亲核进攻联烯酰亚胺1得到两性离子中间体E,随后脱去噁唑烷酮负离子得到α-烯酮基不饱和季鏻盐F;底物甲基酮亚胺2异构形成的烯胺4在噁唑烷酮负离子的作用下,脱去胺质子得到中间体I;然后,中间体I选择性与中间体F的sp杂化碳发生亲核加成得到中间体G,再经分子内的质子转移得到的中间体J,接着发生5-endo-trig环加成反应得到中间体K,然后经1,2-质子迁移得到中间体L;最后,中间体L发生消除反应得到产物5,同时释放出催化剂。当取代基R为H时,产物5最终异构化形成产物3。
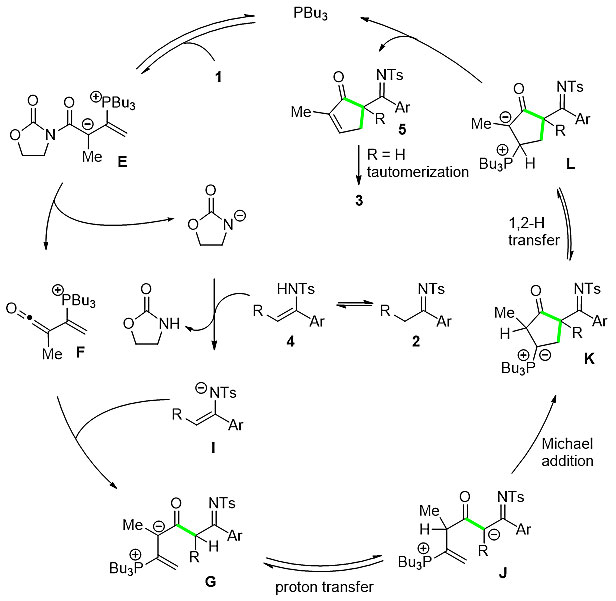
图3. 可能的反应机理
最后,该课题组对反应的合成应用进行了考察(图4)。首先,扩大反应规模,以64%的产率合成了克级量的产物3a,接下来对产物3a进行衍生化反应。通过Pd/C催化的氢气还原,以89%的产率选择性获得环戊烯酮C=C双键被还原的产物6。另外,具有烯胺酮骨架的化合物3a与苯肼经过两次缩合反应得到含吡唑骨架的化合物7。当外消旋α,γ-双甲基取代的联烯酰亚胺1ʹ与对甲苯磺酰胺反应时,需要升高温度至100 ℃,以64%的产率得到外消旋体γ-内酰胺9;当采用手性膦催化剂(R)-SITCP时,能以42%的产率和52% ee获得手性化合物(+)-9。
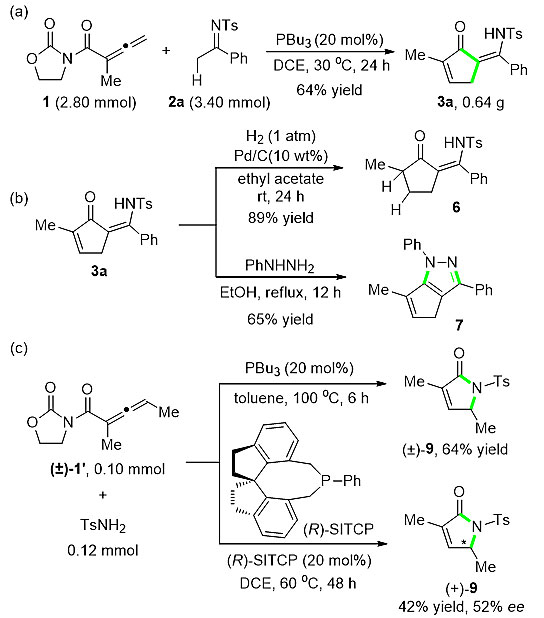
图4. 合成应用
相关研究成果发表在Angew. Chem. Int. Ed.上。该项目研究得到了国家自然科学基金(21573169, 21772151),湖北省自然科学基金(2018CFA084)和武汉理工大学研究生优秀学位论文培育项目(2018-YS-081)的经费资助。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Phosphine-Catalyzed [4+1] Cycloadditions of Allenes with Methyl Ketimines, Enamines, and a Primary Amine
Ze-Hun Cao, Yu-Hao Wang, Subarna Jyoti Kalita, Uwe Schneider, Yi-Yong Huang
Angew. Chem. Int. Ed., 2019, DOI: 10.1002/anie.201912263
导师介绍
黄毅勇
https://www.x-mol.com/university/faculty/22294
 1
1











