除了强大的基因编辑能力外,近年来,研究发现一些CRISPR-Cas系统具有ssDNase/ssRNase性,即在识别及切割目标核酸物的同时,能非特异性切割目标核酸周围的非目标核酸。例如,CRISPR-Cas12a系统在识别和切割目标ss/dsDNA后,能非特异性切割周围非目标ssDNA。CRISPR-Cas系统等温、酶放大特点,为将其应用于生物传感领域提供了理论基础。但是,已有报道的CRISPR-Cas传感器大多只能应用于核酸类目标物的检测,对非核酸目标物的诊断应用有限。因此,开发基于CRISPR-Cas体系的新的信号转化策略,实现核酸之外更广泛的目标物检测,是进一步推广CRISPR-Cas技术的体外诊断应用的关键难点。
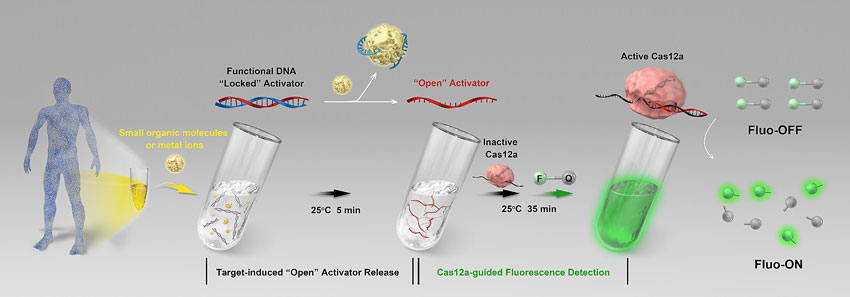
近日,伊利诺伊大学香槟分校陆艺教授(点击查看介绍)团队、南昌大学熊勇华研究员(点击查看介绍)团队及南京大学张晶晶教授(点击查看介绍)团队共同合作,报道了一种基于功能核酸(functional DNA,包括适配体(aptamer)和脱氧核糖核酸酶(DNAzyme))调控CRISPR-Cas12a检测非核酸类目标物的新型传感器方法。其原理如上图所示,当目标物存在时,功能核酸特异性识别目标物,从而释放与之结合的激活DNA (activator),释放后的DNA activator激活Cas12a的ssDNase活性,而激活的Cas12a进一步非特异性地切割两端分别标记了荧光及荧光猝灭基团的ssDNA,最终产生荧光信号。通过使用便携式荧光读取仪,该方法可在室温(25 ℃)条件下快速(<15 min)检测血清中ATP及Na+,表明基于CRISPR-Cas12a的新型传感器适用于现场即时检测。理论上,通过筛选获得各种功能核酸序列,该方法可进一步用于其他小分子化合物、金属离子、病毒、蛋白甚至细胞的高灵敏快速检测。总之,该方法为CRISPR-Cas系统应用于生物医学诊断、环境监控以及食品安全检测等领域提供了一个新的思路。
相关工作发表在Journal of the American Chemistry Society 上,文章的第一作者为南昌大学博士研究生熊颖,陆艺教授、熊勇华研究员及张晶晶教授为论文共同通讯作者。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Functional DNA Regulated CRISPR-Cas12a Sensors for Point-of-Care Diagnostics of Non-Nucleic-Acid Targets
Ying Xiong, Jingjing Zhang, Zhenglin Yang, Quanbing Mou, Yuan Ma, Yonghua Xiong, Yi Lu
J. Am. Chem. Soc., 2019, DOI: 10.1021/jacs.9b09211
导师介绍
陆艺
https://www.x-mol.com/university/faculty/188
https://chemistry.illinois.edu/yi-lu
熊勇华
https://www.x-mol.com/university/faculty/49822
http://sfst.ncu.edu.cn/szdw/jsfc/9d409ffa4cd84e34b21e976f2c3f4b55.htm?a=156
张晶晶
https://chem.nju.edu.cn/zjj_25287/list.htm
https://www.x-mol.com/groups/JJZ_DNA
 0
0









