金属卡宾碳氢键插入反应,特别是利用α-重氮酯类化合物作为卡宾前体,是一类重要的碳氢键烷基化方法(图1a)。近些年来,醌型卡宾(quinoid carbene, QC)的碳氢键插入反应开始得到关注,主要因其醌型结构在插入后会重排成苯酚基团,继而可实现碳氢键的芳基化反应。但是由于醌型卡宾活性较低,大多插入反应都局限于sp2碳氢键,而其中关键的碳氢键活化步骤要么由金属完成(cyclometallation),要么作为非决速步骤在醌重排为苯酚时发生(如Chem. Eur. J., 2018, 24, 4815,其中KIE<1)。最近,香港大学支志明教授(点击查看介绍)课题组分离并研究了一系列二价钌(RuII)醌型卡宾配合物(J. Am. Chem. Soc., 2019, 141, 9027),并发现这些金属卡宾化合物除了卡宾转移反应活性外,还可与sp3碳氢键进行当量的氢转移(hydrogen atom transfer, HAT)反应。基于这一发现,他们通过将金属中心从RuII变为较为亲电的三价铱IrIII,成功实现了醌型卡宾sp3碳氢键插入反应的催化循环并直接得到碳氢键芳基化产物(图1b)。相关结果发表在近期的Angew. Chem. Int. Ed. 上。
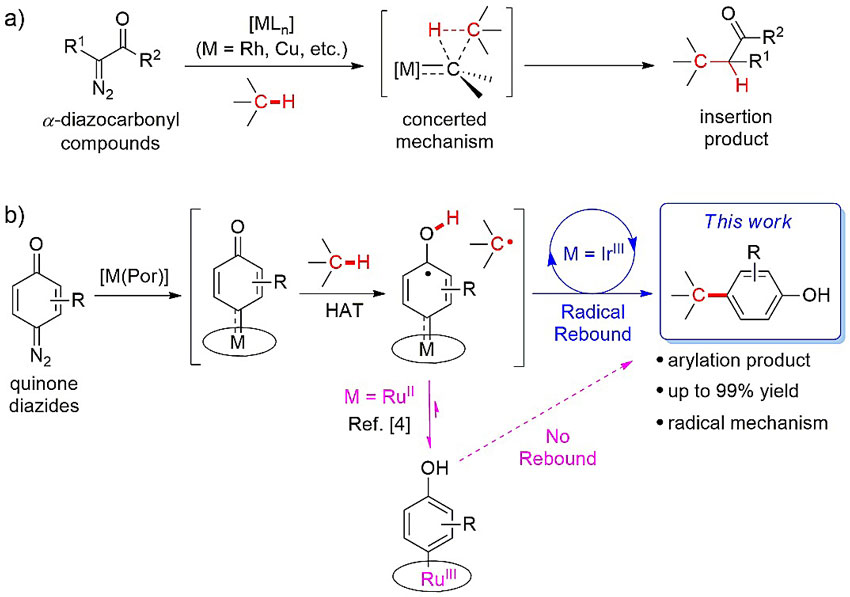
图1. 研究背景。本文的铱催化醌型卡宾sp3碳氢键插入反应,主要基于钌醌型卡宾配合物的氢转移反应性研究(J. Am. Chem. Soc., 2019, 141, 9027)。
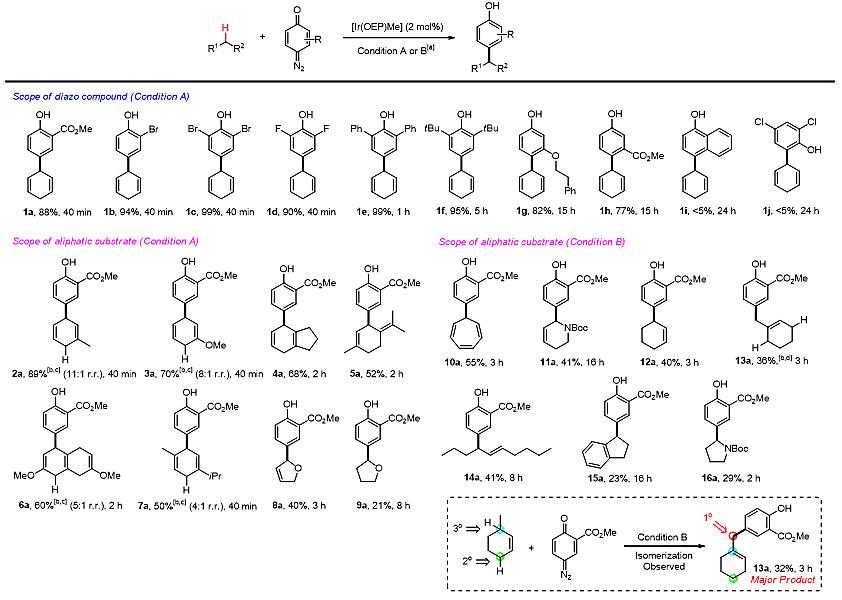
图2. 底物扩展
如图2所示,在铱卟啉催化剂[Ir(OEP)Me]的作用下,醌型卡宾可被插入到活泼的sp3碳氢键底物中。如果以1,4-环己二烯为碳氢键底物,该芳基化反应时间可短至40分钟,产率可接近定量,并可实现克级制备。有趣的是,在以3-环己烯作为底物时,主产物为重排后产物13a(图2虚线内)。
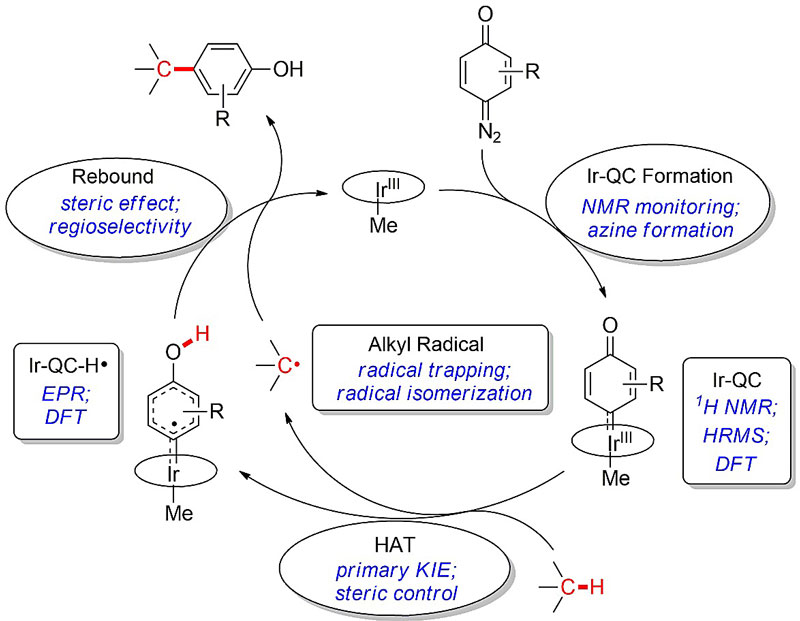
图3. 机理研究小结
本文的重点为机理研究,因为自由基机理在分子间的金属卡宾碳氢键插入反应中十分罕见。作者对催化循环中每一个反应中间体及步骤都进行了实验/理论计算论证(图3)。第一步为重氮化合物分解形成铱卡宾中间体Ir-QC,该活泼中间体被核磁和高分辨质谱表征;azine副产物的生成也侧面说明了活性金属卡宾中间体的存在;DFT计算支持该配合物为闭壳层(closed-shell)物种。第二步为氢转移,该步骤的KIE约为3.2;通过改变各反应物的位阻得出,氢转移应发生在醌型卡宾的羰基氧原子上。该步骤生成两个中间体:其一,碳氢键底物被拔走氢原子生成烷基自由基,该自由基的存在可被TEMPO捕获,而自由基机理也可以解释图2虚线中的重排产物;其二,Ir-QC得到氢原子生成Ir-QC-H•中间体,该中间体被EPR表征(图4b),由于其g值相对于其他Ir(IV)配合物较为接近2.0,故认为其卡宾配体上具有显著的自由基特征(图4c的A结构);而这一特征也与DFT计算相吻合(图4a)。在文献中,具有氢转移活性的金属卡宾中间体仅限于开壳层(open-shell)物种,而之所以闭壳层的Ir-QC能够进行氢转移反应正是因为其独特的醌型结构:其离域的分子轨道使得羰基氧原子也处在LUMO中,因而可以发生类似于苯醌类化合物的氢转移反应。催化循环中的第三步,也是本文的关键,为自由基重组(radical rebound)。在之前RuII-QC的工作中,发生氢转移后并没有进行自由基重组,这是由于RuII较为富电子,生成的卡宾自由基很快被其还原,从而得到稳定的RuIII-aryl而无法进行自由基重组。而相比于RuII,IrIII更加缺电,还原性更差,在进行氢转移后未成对电子主要集中在卡宾配体上(图4c的A结构)而非金属上(图4c的B结构),因而更倾向于发生自由基重组。在催化剂筛选和底物扩展中,作者发现该反应体系对位阻十分敏感,而这也很有可能与较慢的自由基重组有关。
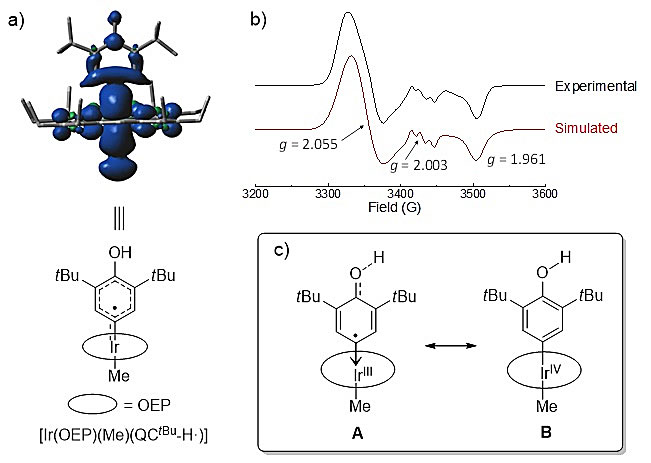
图4. Ir-QC-H•中间体的表征
本文的通讯作者为香港大学支志明教授,第一作者为王海旭博士。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Iridium(III)‐Catalyzed Intermolecular C(sp3)−H Insertion Reaction of Quinoid Carbene: A Radical Mechanism
Hai‐Xu Wang, Yann Richard, Qingyun Wan, Cong‐Ying Zhou, Chi‐Ming Che
Angew. Chem. Int. Ed., 2019, DOI: 10.1002/anie.201911138
导师介绍
支志明
https://www.x-mol.com/university/faculty/69057
 0
0












