基于生物材料的非病毒性肿瘤疫苗是近年来肿瘤免疫治疗领域的又一研究热点。合理设计安全有效的肿瘤疫苗,构建高效靶向抗原呈递细胞的肿瘤疫苗递送系统有重要的科研和临床意义。脾是人类成体最大的淋巴器官,激活脾脏区域的抗原呈递细胞能够激发全身的抗肿瘤免疫反应,产生良好的抗肿瘤效果。然而,通过静脉给药且具有高效靶向脾脏区域功能的肿瘤疫苗目前还鲜有报道。
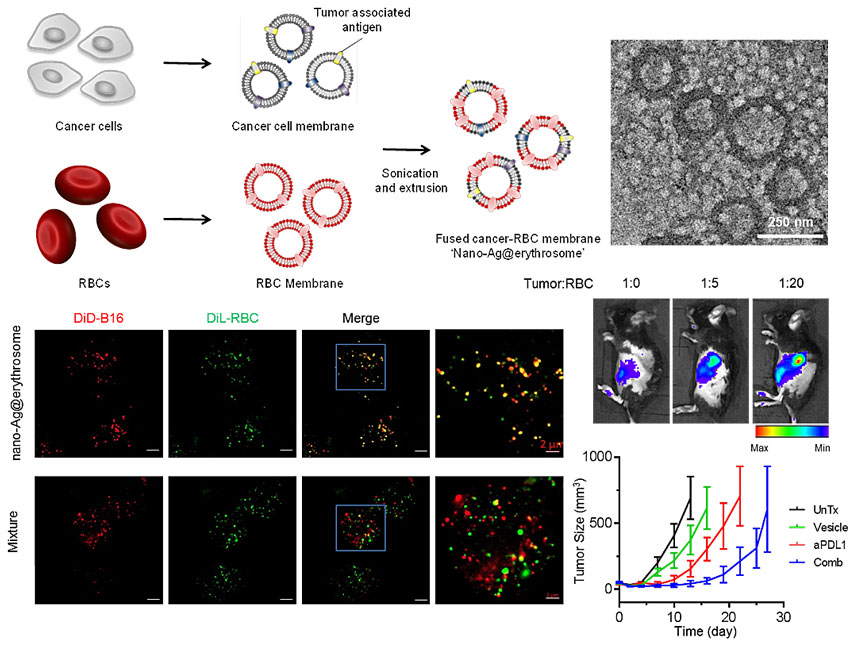
红细胞和基于红细胞膜的生物材料由于其固有的生物相容性,是一类理想的药物递送载体。有研究表明,由于脾脏的抗原呈递细胞对红细胞碎片和衰老的红细胞具有极强的靶向吸附能力,在这篇工作中,作者巧妙利用红细胞本身性质,构建一种基于红细胞膜的新型肿瘤纳米疫苗,靶向递送肿瘤疫苗至脾脏等免疫器官。肿瘤细胞膜表面表达许多抗原,因此在设计中,作者用红细胞膜和肿瘤细胞膜制成混合膜囊泡,由此模拟衰老的红细胞膜囊,从而把肿瘤抗原靶向到脾脏的两大抗原呈递细胞-巨噬细胞和树突状细胞。
作者先通过超声提取红细胞和肿瘤细胞膜,随后用膜融合的方法将两种膜按照一定比例融合成纳米融合膜囊泡。体内研究表明,抗原融合的纳米红细胞囊泡可以直接靶向脾脏的抗原呈递细胞。在小鼠注射抗原融合的纳米红细胞囊泡后,血清中活化的DC和巨噬细胞释放的多种细胞因子显着增加。与此同时,联合anti-PD-L1免疫检查点阻断后,在针对B16F10和4T1肿瘤的小鼠模型中观察到协同抗癌作用。
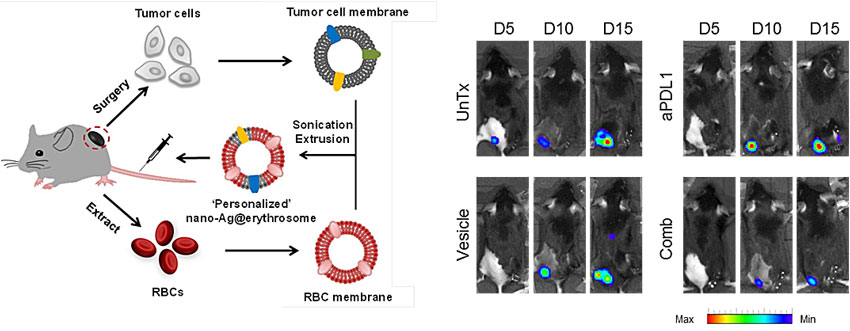
此外,作者进一步利用切除肿瘤组织的肿瘤抗原来治疗转移性肿瘤,通过模拟癌症患者手术后转移性肿瘤的现实情况来证明临床相关性。“个性化”纳米红细胞结合检查点阻断可以显着增强抗癌免疫反应,减少原发肿瘤切除后的转移性肿瘤。该结果显示了这种基于红细胞囊泡的个性化癌症治疗策略的重大前景。
这一成果近期发表在Science Advance 上,文章的第一作者是苏州大学硕士研究生韩潇和沈淑芳。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Red blood cell–derived nanoerythrosome for antigen delivery with enhanced cancer immunotherapy
Xiao Han, Shufang Shen, Qin Fan, Guojun Chen, Edikan Archibong, Gianpietro Dotti, Zhuang Liu, Zhen Gu, Chao Wang
Sci. Adv., 2019, 5, eaaw6870, DOI: 10.1126/sciadv.aaw6870
汪超教授简介

汪超,苏州大学功能纳米与软物质研究院教授。在 Sci. Transl. Med., Nat. Biomed. Eng., Sci. Adv., Adv. Mater., Adv. Funct. Mater., Nano Lett., ACS Nano, Biomaterials, J. Control Release 等知名期刊发表 SCI 论文 90 多篇,总引用 11,000余次,H 因子 47。入选科睿唯安“全球高被引科学家”名录(2018-2019)、江苏省特聘教授(2018)、江苏省双创人才(2019)等。汪超教授课题组主要研究方向为生物材料与免疫工程交叉领域,具体包括基于生物材料,发展新型免疫治疗策略,针对肿瘤,炎症,衰老,自身免疫病等免疫相关疾病。课题组招聘博士后,待遇优厚,并可推荐海外名校继续深造,欢迎对相关方向有兴趣的同学前来咨询。如有兴趣,请联系cwang@suda.edu.cn。
课题组网页
https://www.x-mol.com/groups/cwang
 0
0












