哌啶是含氮杂环药物中的关键结构,目前已发展了多种立体选择性地构建哌啶环的策略。此外,哌啶的N-芳基化和N-(杂)芳基化是制备各种潜在药物分子的基本策略,传统的C(sp2)-N键构建方法依赖于SNAr反应或过渡金属催化的交叉偶联反应(图1a),但仍存在一定的局限性,例如富电子芳烃包括五元杂环就不适于SNAr反应。C-N交叉偶联反应虽然克服了这些限制,但哌啶与五元杂芳烃的偶联仍然极具挑战性。此外,β-氢消除或去质子化过程也可能会导致Pd-催化的C-N偶联的立体选择性降低。
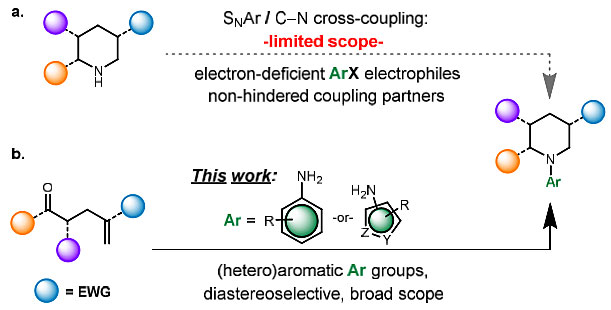
图1. N-芳基哌啶的合成方法。图片来源:J. Am. Chem. Soc.
近日,美国默克公司Aaron C. Sather等研究者为了克服这些方法上的限制,利用选择性断键的策略来制备N-(杂)芳基哌啶,即从相对简单的前体出发来制备在环上任何位点取代的产物。具体而言,从广泛使用的杂环胺亲核试剂出发,通过非对映选择性还原胺化/Aza-Michael法来制备官能团化的N-(杂)芳基哌啶(图1b),该方法对空间位阻具有高度的耐受性,并能合成传统N-(杂)芳基化法难以制备的产物,相关成果发表在J. Am. Chem. Soc.上。
首先,作者选择底物A和B进行条件优化(图2)。还原胺化步骤相对简单,在DCE以及三乙酰氧基硼氢化钠(STAB)的条件下,能够以较快的反应速率和较高的收率分离出线性中间体(1)。接下来,作者探讨了溶剂和温度对随后的aza-Michael环化效率和选择性的影响。1在三氟乙醇(TFE)中于60 °C下加热,以8:1的非对映体比例(dr)定量转化为所需的产物(有利于顺式异构体2a),且未检测到副产物内酰胺3。在EtOH中的反应明显比TFE中复杂,而在MeOH中反应时,则以定量的产率得到目标产物且非对映选择性有所提高(cis:trans = 11:1)。出乎意料的是,当向醇溶剂中加入水时(50% v/v),反应速率和非对映选择性均显著提高,并将温度降低到30 °C时dr值得到了进一步的提高,最终确定了最佳的溶剂组合是MeOH/H2O,以20:1 的dr值得到2a。最后,作者发现该方法可以不分离1:即在还原胺化之后,用NaOH简单淬灭过量的STAB,并用MeOH/H2O进行溶剂交换,2a的产率或选择性都没有损失。

图2. 溶剂和温度对非对映选择性的影响。图片来源:J. Am. Chem. Soc.
有了最佳反应条件后,作者接下来考察了酮底物B的范围(图3)。脂肪酮的耐受性良好(2a、2b);具有不同电性的苯乙酮衍生物也能兼容该反应(2c-2e),但由于其还原胺化步骤更具挑战性,导致产率较低。环酮主要得到了全顺式十氢喹啉(2f)。除α、β-不饱和酯外,氰基烯烃(2g)、硝基烯烃(2h,j)和2-乙烯基吡啶(2i)都是合适的Michael受体,这表明该方法能够兼容C5位上的多种取代基,从而实现进一步的衍生化。值得注意的是,硝基苯基烯烃受体的高反应活性使其形成了具有特殊位阻的2,5,6-三取代哌啶2j,其中N1两侧为苯基和甲基。不饱和酯系列(2k和2l)中链长度的变化表明,一般反应是特定于形成六元环的:对于链缩短的酮,根据Baldwin规则完全形成内酰胺2k。而试图通过同系物酮生成氮杂七元环2l,结果只得到还原胺化产物。
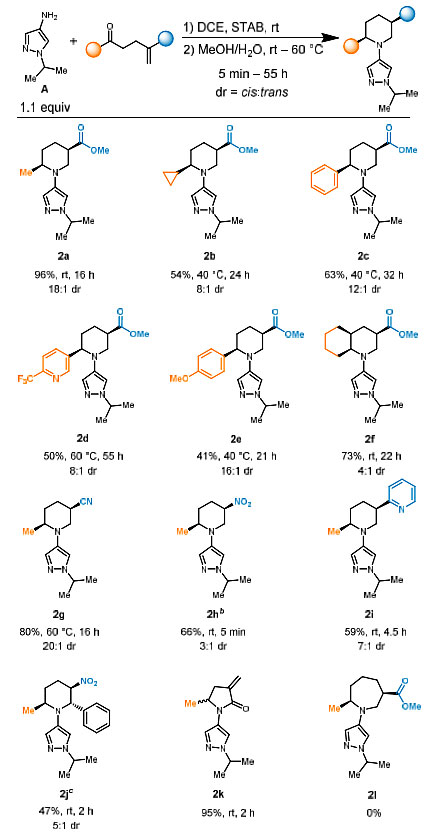
图3. 含酮亲电试剂的底物扩展。图片来源:J. Am. Chem. Soc.
接着,作者将这种方法扩展到含醛的亲电试剂,就能够非对映选择性地制备3,5-二取代哌啶(图4)。由于这些底物的还原胺化反应相对简单,可以在甲醇中进行,因此,可以向反应中加水实现环化过程。尽管在某些情况下会形成类似于内酰胺3的副产物,但是3,5-二取代哌啶产物4a-4f仍具有中等到良好的产率和优异的非对映选择性。醛底物的环化反应与酮体系相似,具有相似的官能团耐受性,但主要生成的是反式二取代哌啶。
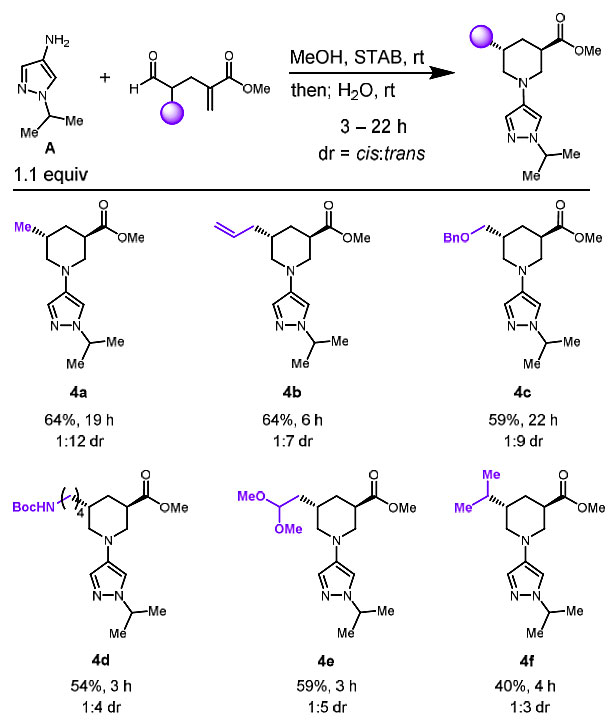
图4. 含醛亲电试剂的底物扩展。图片来源:J. Am. Chem. Soc.
随后,作者探讨了亲核试剂的范围(图5)。值得注意的是,该反应中使用TFE/H2O能显著提高环化速率,因此选择TFE/H2O作为溶剂。苯胺衍生物能以良好的产率和非对映选择性(5a-5f)得到顺式2,5-二取代哌啶;然而,当苯胺邻位带有取代基时,需要较高的反应温度才能完全转化,并导致非对映选择性降低(5c vs. 5d)。给电子基取代的3-氨基吡啶也可以形成相应的哌啶(5g、5h),其非对映体比例与其他苯胺相似。如5h所示,将该方法应用于电性不同的双(氨基)杂环底物,选择性地生成N-(杂)芳基哌啶,而在相应的二卤杂环的SNAr反应或C-N交叉偶联反应中则得到相反的区域选择性。此外,官能团化或带位阻的五元杂芳胺也能以良好的产率得到顺式二取代哌啶(5i-5r),但有时需要较高的温度和较长的反应时间才能实现有效的环化(5n-5p、5r、5s)。
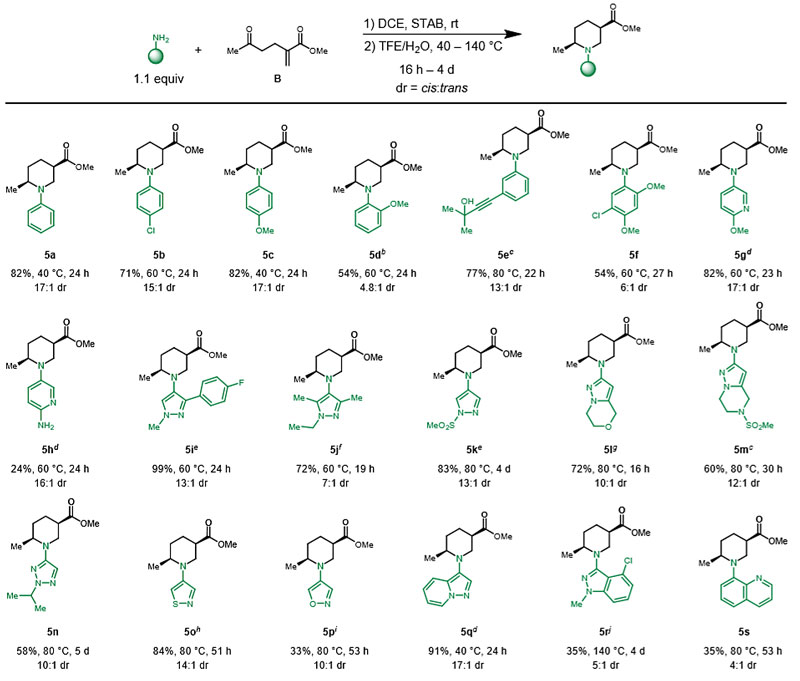
图5. N-亲核试剂底物扩展。图片来源:J. Am. Chem. Soc.
该方法的优势在于通过还原胺化/Aza-Michael环化获得的优异非对映选择性,但有关这种选择性的机理并不清楚,为了解决这一问题,作者进行了计算研究。DFT计算表明,两种可能的非对映体(5a和5a-trans)的能量相似,表明非对映选择性是由动力学控制的。为了证实这一结果,作者计算分析了Int-5a和Int-6a 发生aza-Michael反应的exo-环烯醇中间体8和9的构象(图6a、6b)。在没有明显溶剂化的情况下,计算化学预测了8的有利构象,在质子化时,会产生与实验结果相反的非对映异构体,而9的非对映选择性将被低估。众所周知,特定的溶剂-溶质相互作用,对于准确描述质子溶剂中胺的溶剂化是很重要的。事实上,当一个或两个水(或MeOH)分子与溶剂形成氢键时,8和9能量最低的构象将从exo-面质子化,得到实验观察到的非对映体5a和6a。该计算模型预测的非对映体比率与实验值高度吻合。
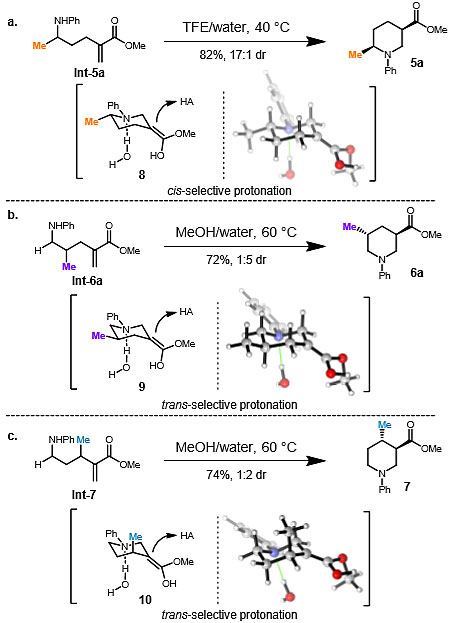
图6. 计算模型对dr选择性的预测。图片来源:J. Am. Chem. Soc.
作者还进一步扩展了本文的合成方法,考察了β-烷基醛与苯胺的反应,形成了4,5-二取代哌啶7(图6c)。对于能量最低的构象8和9,甲基位于e键;而对于10,为了避免A1,3张力这种不利的相互作用使甲基处于a键。质子化优先发生在10的exo-面,得到7。与此推理相符,作者发现Int-7能够以较高收率进行环化反应,得到反式非对映体为主要产物(cis:trans = 1:2)。
总结
美国默克公司Aaron C. Sather团队开发了一种新型的还原胺化/Aza-Michael反应策略,可制备各种各样的N-芳基和N-杂芳基哌啶,从简单的前体开始,具有稳健和可预测的非对映选择性。这种方法很容易制备许多与药物相关的产物,是对传统N-(杂)芳基化反应的重要和实用的补充;它具有模块化和高度的官能团耐受性,这将是一个广泛有用的合成工具。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

A Modular and Diastereoselective 5 + 1 Cyclization Approach to N-(Hetero)Aryl Piperidines
Matthew A. Larsen, Elisabeth T. Hennessy, Madeleine C. Deem, Yu-hong Lam, Josep Saurí, Aaron C. Sather
J. Am. Chem. Soc., 2020, 142, 726-732, DOI: 10.1021/jacs.9b13114
 0
0