英文原题:NIR-II Dye-based Multifunctional Telechelic Glycopolymers for NIR-IIa Fluorescence Imaging-guided Stimuli-responsive Chemo-Photothermal Combination Therapy
通讯作者:Pengfei Sun(孙鹏飞),Nanjing University of Posts & Telecommunications; Jiewei Li(李杰伟),Nanjing Tech University;Quli Fan(范曲立),Nanjing University of Posts & Telecommunications
作者:Shangyu Chen(陈尚钰), Bo Sun(孙博), Han Miao(缪函), Gaina Wang(王改娜), Pengfei Sun(孙鹏飞), Jiewei Li(李杰伟), Wenjun Wang(王文军), Quli Fan(范曲立) and Wei Huang(黄维)
近年来,光学成像介导的化疗-光热联合疗法正成为一种有潜力的癌症治疗策略。在光学成像中,相比于近红外一区荧光成像 (650-900 nm) 和光声成像模式,近红外二区 (NIR-II,1000-1700 nm) 荧光成像,特别是在NIR-IIa (1300-1400 nm) 区间内,其具有高分辨率、高穿透深度和成像速度快、范围广的优势。但是,NIR-II荧光成像在引导化疗-光热联合使用中仍存在两大问题亟待解决。第一,大部分报道的NIR-II染料的发射峰主要集中在1000-1100 nm,NIR-IIa区域荧光较弱,使成像的信噪比不够理想;第二,NIR-II荧光造影剂均不易修饰功能性聚合物,这限制了其对药物分子的负载及可控释放。
近日,南京邮电大学黄维院士(点击查看介绍)团队范曲立教授(点击查看介绍)课题组在线报道了一种含NIR-II染料的多功能遥爪糖聚合物用于NIR-IIa荧光成像介导的刺激响应型化疗-光热联合治疗。如图1所示,该课题组首先设计合成了NIR-II小分子染料TTQ-TC。对该染料的光物理性质进行表征,发现它的吸收和发射都到达近红外区域。这是由于强受体TTQ的引入,降低了分子能级之间的能量带隙。更重要的是,TTQ-TC有着一个明显的NIR-IIa尾峰,并且该发射尾峰与主峰的比值比文献报道的基于BBTD受体的小分子如CH1055,要高出近3倍。因此,TTQ-TC有希望增强活体中NIR-IIa区域的荧光强度以获得高信噪比成像效果,并进一步用于NIR-IIa成像介导的化疗-光热联合治疗。
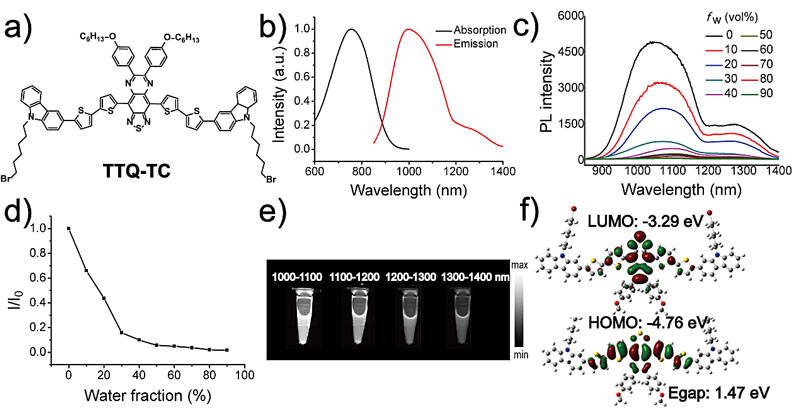
图1. 小分子染料的化学结构及光物理性质
为通过“graft-from”方式接枝功能性聚合物实现对NIR-II染料TTQ-TC的功能化修饰。他们对TTQ-TC进行了化学修饰,得到了可用于可逆加成断裂链转移(RAFT)聚合的小分子链转移剂(TTQ-TC-CTA)。以TTQ-TC-CTA为链转移剂利用可控的活性RAFT聚合方法,成功地合成出一种含NIR-II染料TTQ-TC的双臂遥爪果糖聚合物(TTQ-TC-PFru)(图2)。
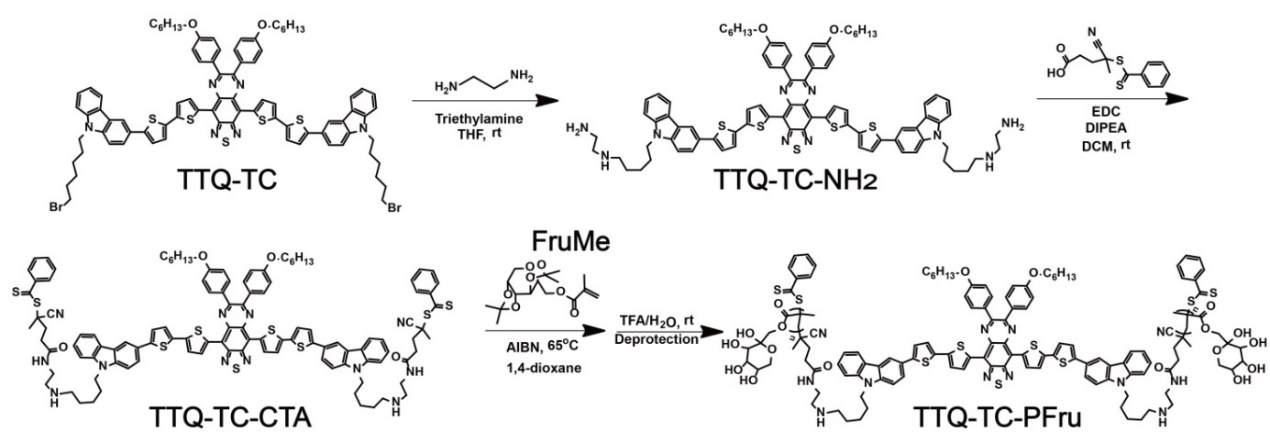
图2. 果糖聚合物的合成路线
随后作者对该果糖聚合物进行了表征(图3),果糖聚合物的引入赋予它理想的水溶性。同时,TTQ-TC-PFru还拥有着有机小分子理想的光学性质,在NIR-II区间内有着较强的荧光信号,良好光稳定性并且成像的最大穿透深度可接近8 mm。因此,该果糖聚合物可进一步应用于体内成像。
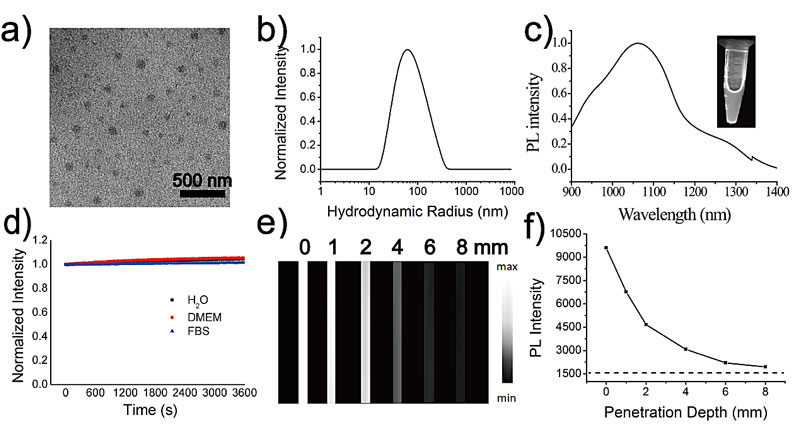
图3. 果糖聚合物的粒径分析及光物理性质
为了验证该果糖聚合物TTQ-TC-PFru是否具有理想的NIR-IIa荧光成像效果,该团队又对健康小鼠的后肢、大脑和腹部的血管以及淋巴系统进行了成像,并比较了他们在不同波长滤光片下的成像信噪比(图4)。实验发现,随着滤光片的波长从1000 nm增加到1400 nm,血管图像的清晰度得到了显著改善。特别是在NIR-IIa的1300-1400 nm滤光片下捕获的图像中实现了最大的成像对比度和信噪比。这也充分证明了该含NIR-II染料的果糖聚合物TTQ-TC-PFru具备优异的体内NIR-IIa成像效果。
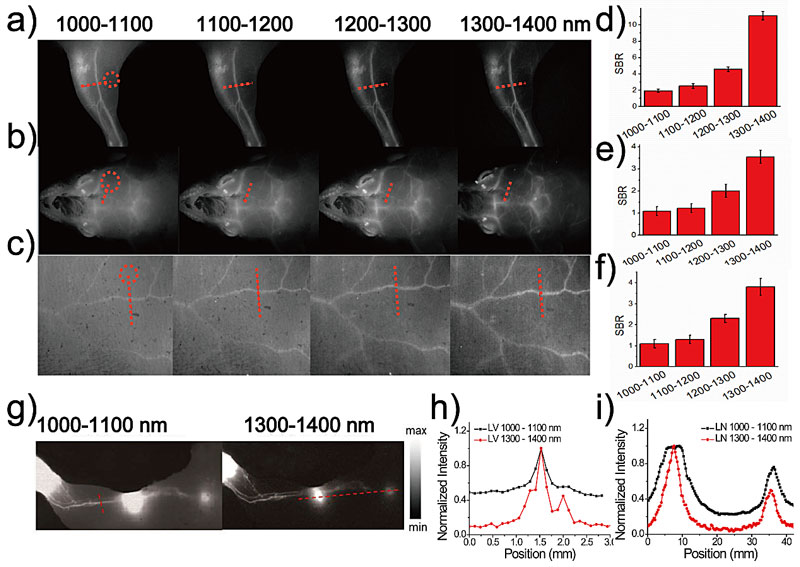
图4. 果糖聚合物的高分辨血管成像
为了解决目前大多数载药体系生理稳定性差、药物负载率低和药物释放不可控的问题,该课题组针对该果糖聚合物,特别选择了一种硼替佐米(BTZ)抗癌药物,巧妙地利用BTZ药物的硼酸基团与果糖中二羟基的相互作用,成功将药物BTZ负载在糖聚合物TTQ-TC-PFru中。由于BTZ药物与果糖之间的动态共价键对酸敏感,可实现药物在肿瘤位置的可控释放。针对血液中葡萄糖对载药体系稳定性的影响,他们又引入一种含硼酸半酯的无规共聚物POEGMA-co-PBOB来进一步提高体内运输的血液稳定性。从图5的DLS图可以看出,粒径的变化证明了药物的成功负载,并且在葡萄糖的缓冲液中有着理想的稳定性。体外药释也证明了该体系的酸响应药物释放。在进一步的光热性能测试中,该载药纳米粒子表现出优异的光热性能,光热转换效率为28%,可适用于癌症的光热治疗。
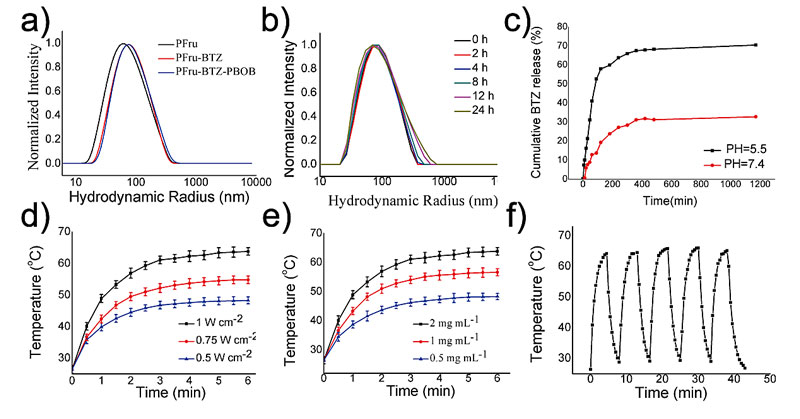
图5. 载药纳米粒子的粒径分析、药物释放及光热效应
为了验证该载药纳米粒子的抗癌效果,课题组首先对载药纳米粒子的体外细胞的协同治疗进行了研究。如图6所示,MTT和流式实验都证明了化疗-光热的联合治疗有着最好的治疗效果。
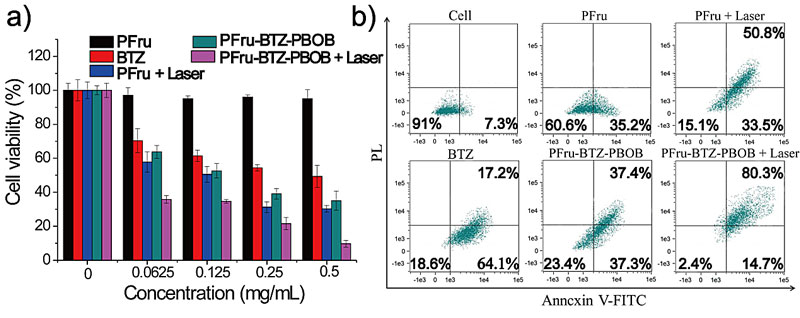
图6. 载药纳米粒子的体外协同治疗研究
最后,他们对有着肿瘤模型的活体小鼠进行了治疗(图7)。首先通过高分辨的NIR-IIa荧光成像确定载药纳米粒子在肿瘤处的最大富集时间,即是最佳的光热治疗时间点。然后在该时间点用808 nm激光光照5 min进行光热治疗。由于肿瘤微环境是偏酸性的,药物可在肿瘤处定点释放实现化疗-光热的协同治疗。小鼠肿瘤模型的数据表明了该课题组设计合成的含NIR-II染料的遥爪糖聚合物可用于负载药物BTZ,实现在肿瘤部位的BTZ药物酸激活释放及光热治疗。
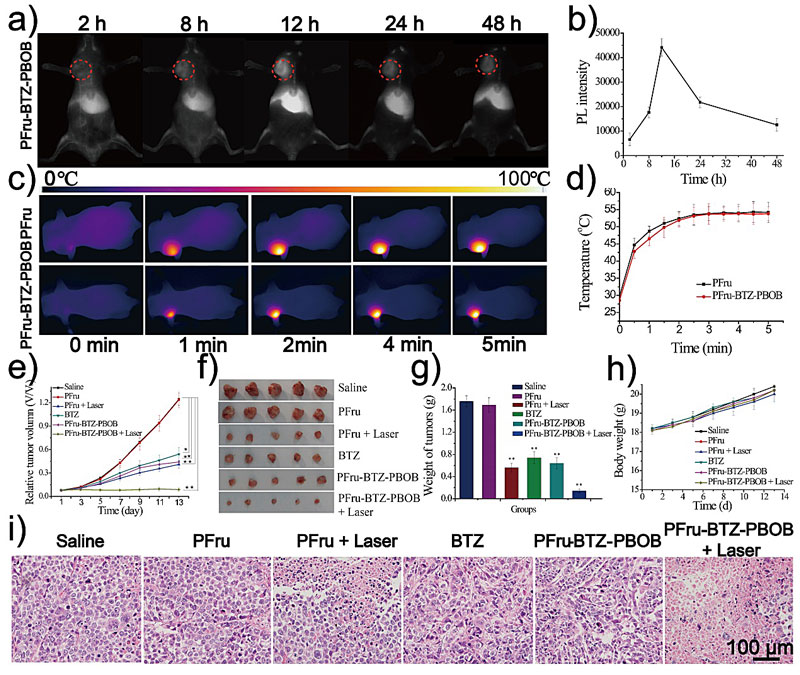
图7. 肿瘤小鼠的荧光成像以介导化疗-光热疗联合治疗
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

NIR-II Dye-Based Multifunctional Telechelic Glycopolymers for NIR-IIa Fluorescence Imaging-Guided Stimuli-Responsive Chemo-Photothermal Combination Therapy
Shangyu Chen, Bo Sun, Han Miao, Gaina Wang, Pengfei Sun*, Jiewei Li*, Wenjun Wang, Quli Fan*, Wei Huang
ACS Materials Lett., 2020, 2, 174-183, DOI: 10.1021/acsmaterialslett.9b00480
Publication Date: January 13, 2020
Copyright © 2020 American Chemical Society
导师介绍
黄维
https://www.x-mol.com/university/faculty/35089
范曲立
https://www.x-mol.com/university/faculty/39457
(本稿件来自ACS Publications)
 0
0











