含有环氧环的分子是一类重要的共价抑制药物。具有张力的环氧环在药物靶点中,被活性口袋中氨基酸残基(如半胱氨酸)亲核进攻开环,从而实现对药物靶点的共价结合。天然存在的抗生素——磷霉素就是一个典型的例子。磷酸素是上世纪Merck公司研究人员从链霉菌中分离、鉴定出的广谱抗生素,目前依然是临床上用于尿道感染治疗的一线药物。
在链霉菌株中,S-2-羟丙基磷酸环氧化酶(HppE)是磷霉素生物合成路径最后一步负责组装环氧环的酶。HppE是一类独特的非血红素铁酶。对于HppE如何催化组装磷霉素环氧环的反应机制研究始于上世纪90年代,直到目前,一些细节仍不清楚。HppE作为氧化酶被研究了十多年,直到2013年,宾夕法尼亚州立大学的J. Martin Bollinger, Jr.(点击查看介绍)和Carsten Krebs(点击查看介绍)课题组通过酶动力学研究,将HppE从新定义为过氧化氢酶(Science, 2013, 342, 991-995)。近期,该课题组科研人员通过底物设计、定点突变和抗菌活性初筛等实验相结合,揭示了该酶是通过疏水氨基酸残基驱使了底物中间体自由基反生构型反转,从而产生了更具抗菌活性的顺式环氧环——磷霉素。该文章发表于在J. Am. Chem. Soc. 期刊上。
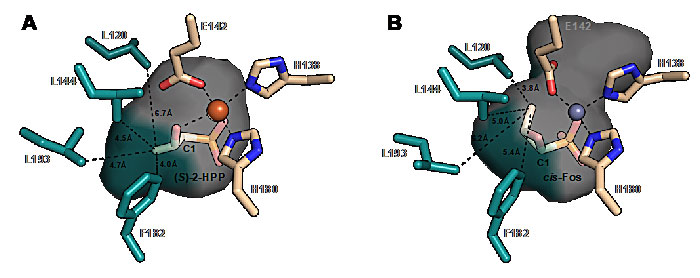
HppE组装磷霉素环氧环分为两步:(1)攫取C1-pro-R氢原子;(2)C2氧原子和C1位反生偶联。前期选择性氘代底物实验清楚地表明,环氧环的形成仅源于C1-pro-R氢原子的攫取,但C1-pro-R的氢原子被攫取后生成的碳自由基与C2位氧原子之间的直接偶联只会生成反式环氧环,而不会产生最终的天然产物顺式磷霉素。换言之,在这一过程中C1发生构型反转。为了解释这一现象,研究人员提出三种机制:1)邻位磷酸基团辅助,先通过构型保持生成一个不太稳定P-O-C三元环,然后C2位氧负离子从该三元环的背面亲核进攻(SN2)实现构型反转;2)C1自由基转移到三价铁上生成平面的碳正离子,C2位氧负离子选择性地从碳正离子的一面进攻形成顺式环氧环;3)C1自由基反生构型反转生成相反构型的自由基,该自由基与C2氧原子的偶联满足形成顺式环氧环的要求。第一种邻位参与的机理假设仅会产生一种结果即顺式环氧光环,而后两种机理(C正离子和自由基反转)均有可能产生顺式和反式两种结果。

首先,研究人员分离鉴定出在该酶的催化过程中生成了~5%的反式磷霉素,这一结果表明HppE仅有95%的选择性产生顺式磷霉素,而非之前默认的100%的顺式选择性,同时选择性氘代底物实验证明了反式磷霉素依然源于C1-pro-R氢原子的攫取,综合这些结果排除了邻位参与的机理假设。接着,研究人员在底物的C1、C3位引入氟原子或氯原子,发现HppE依然具有生成环氧化环的能力,这些结果大大降低了该反应通过碳正机理发生的可能性。因为氟取代可以显著地降低碳正离子的稳定性。例如,比较乙铵离子(pKa 10.8)和2,2,2-三氟乙铵离子(pKa 5.6)可以发现,三氟取代使得β-氮的pKa下降~5单位,对应的离子稳定性也下降~30 kJ/mol (20 ℃)。这些结果也使得第三种机理——自由基反转变得最有可能。为了解答底物自由基为什么要发生反转,研究人员对比了已经发表明的底物和产物分别与HppE的复合物结构,发现底物和产物的C3甲基分别处于酶催化口袋底部疏水区域的两端。其中疏水氨基酸L193,F182和L144靠近底物C3甲基,被定义位底物C3口袋,而产物的C3甲基则远离了这一口袋,更靠近疏水残基L120,其被定义为产物C3口袋。研究人员合理地推断出,压缩底物C3口袋会增加C1自由基反转和生成顺利磷霉素的比例,然而扩张这一口袋则会大大消除C1自由基反转的驱动力,反式磷霉素则变成主要产物;同样地压缩产物C3口袋则会增加生成顺式磷霉素的难度。接着研究人员通过定点突变和多种底物实验,验证了上述所有的推断,在底物C3口袋中,用大位阻的疏水氨基酸苯丙氨酸(F)取代亮氨酸(L)得到的突变体L193F实现了几乎100%的C1构型反转和顺式选择性,而用小位阻的丙氨酸(A)取代苯丙氨酸(F)得到的突变体F182A则大大消除了C1反转的驱动力,得到88%~100%的反式选择性。并且研究人员再次通过选择性氘代底物实验证明了,这些对酶的修饰均不改变C1-pro-R氢原子被攫取的前提,换言之,所有的调节均反生在攫氢之后,酶及突变体对C1自由基两种构型具有不同的稳定作用。最后,将得到的顺反磷霉素及氟代衍生物进行抗菌活性初筛,结果表明,顺式磷霉素的活性要明显好于反式磷霉素,这一结果表明了HppE控制的C1构型反转具有重要的生物学意义。综合所有的结果表明:酶和底物独特的立体相互作用驱使了中间体自由基的反转,从而形成了更具抗菌活性的顺式磷霉素。
这篇文章入选了JACS 最近发表的亮点文章[1]。Sarah Anderson评论到这份工作反转了我们对于酶催化的环氧环形成的理解,揭示了一种在环氧环生物合成中对于立体化学控制的独特的生物学策略,该策略可以用于开发全新的、具有活性的合成抗生素。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Steric enforcement of cis-epoxide formation in the radical C–O-coupling reaction by which (S)-2-hydroxypropylphosphonate epoxidase (HppE) produces Fosfomycin
Shengbin Zhou*, Juan Pan, Katherine M. Davis, Irene Schaperdoth, Bo Wang, Amie K. Boal, Carsten Krebs*, J. Martin Bollinger Jr.*
J. Am. Chem. Soc., 2019, 141, 20397-20406, DOI: 10.1021/jacs.9b10974
导师介绍
J. Martin Bollinger, Jr.
https://www.x-mol.com/university/faculty/1047
Carsten Krebs
https://www.x-mol.com/university/faculty/1065
参考资料:
1. Spotlights on Recent JACS Publications
https://pubs.acs.org/doi/10.1021/jacs.0c01221
 0
0










