细胞在生长过程中一直与周围微环境相互作用,研究表明细胞微环境能够调控细胞的诸多行为和功能,比如细胞粘附、铺展、迁移、增殖和分化等。然而真实条件下细胞微环境复杂且动态变化的,而现有的体外模型往往只考虑微环境中的单一因素,难以研究两种及两种以上因素的协同作用。例如,表皮生长因子受体(EGFR)能够参与到整合素介导的信号通路中进而调控细胞的铺展和运动功能,该过程同时受到化学信号和机械信号的调节,但目前这一过程由于缺乏相应的平台难以在体外进行研究。
近期,清华大学的林金明教授(点击查看介绍)团队报道了一种微流控芯片,能够产生正交的硬度梯度和化学梯度,进而研究硬度和表皮生长因子(EGF)对胶质瘤细胞的协同作用。作者使用移动光聚合法在芯片的培养腔中整合了具有从~1 kPa到40 kPa的连续硬度梯度的聚丙烯酰胺(PAA)凝胶片,在正交方向上设计了U型通道和微通道阵列产生基于扩散的EGF梯度(图1)。正交梯度的构建使得作者能够根据细胞的位置“编码”细胞所处的微环境并进行分析。

图1. 正交梯度刺激下不同位置上胶质瘤细胞的行为差异
利用这一平台,作者首先研究了基底硬度对于胶质瘤细胞形态的影响,通过分析与细胞形态相关的几个关键参数,发现细胞铺展面积和纵横比随基底硬度的升高而升高,而细胞圆度的趋势则与之相反,但这些参数在硬度达到一定程度后便趋于稳定。进一步地,作者研究了基底硬度对胶质瘤细胞内ROS表达水平的影响,发现ROS表达水平随着PAA凝胶硬度的增加而降低,软端的ROS水平大约是硬端ROS水平的1.8倍。最后,作者研究了硬度和表皮生长因子的协同作用,凝胶硬度能够促进细胞的趋化性,EGF体则则能够加速细胞迁移(图2)。该研究中构建的平台具有通用性,在体外微环境模拟方面具有广阔前景。
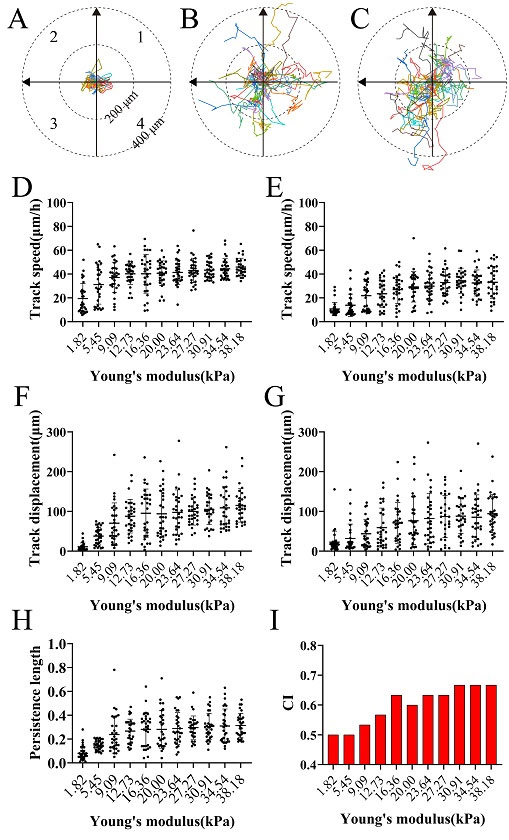
图2. 正交梯度下胶质瘤细胞迁移分析
这一成果近期发表在Analytical Chemistry 上,第一作者为清华大学化学系博士生窦金鑫同学。该研究得到了国家自然科学基金(No. 21775086, 21435002, 21621003)的资助。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Combination Stiffness Gradient with Chemical Stimulation Directs Glioma Cell Migration on a Microfluidic Chip
Jinxin Dou, Sifeng Mao, Haifang Li*, Jin-Ming Lin*
Anal. Chem., 2019, 92, 892-898. DOI: 10.1021/acs.analchem.9b03681
导师介绍
林金明
http://www.linlab-tsinghua-edu.org/
https://www.x-mol.com/groups/Linlab
 0
0









