膜蛋白作为细胞膜的主要组成部分,在细胞识别、信号转导和物质运输等方面发挥着重要作用,其表达与分布形态的改变都有可能引发多种疾病。因此,理解膜蛋白在细胞膜上的分布形态及组装的分子机理至关重要。上皮细胞黏附分子(EpCAM)是一种I类跨膜糖蛋白,由于其在多种癌细胞中过量表达而被作为癌症诊断与治疗的靶点。之前的研究大多数关注于EpCAM在生物功能方面的作用,例如,细胞黏附、信号转导、细胞迁移与分化,然而EpCAM在细胞膜上的精确分布以及组装机理尚未得知。
解决这一问题的最好方法是直接观测膜蛋白的分布,但由于膜蛋白尺寸在光的衍射极限以下,传统的荧光显微镜不能满足要求,幸运的是最近发展的超分辨荧光显微镜克服了衍射极限并越来越多的用于膜蛋白的研究。相对于其他超分辨技术而言,基于单分子定位的超分辨荧光显微镜具有较高的空间分辨率,较便捷的操作而得到广泛的应用。该技术基于单个荧光分子的定位,用成千上万张原始图像重构一张超分辨图像。因此为了获得更准确的定位点信息,需要精确而完整的标记方法。抗体是一种普遍采用的标记分子,但它尺寸相对较大且是多价态,在识别膜蛋白时存在潜在的空间位阻与交联现象,不过近期出现的一些小分子,例如适配体、多肽等,为单分子识别开拓了一个新思路。
针对上述问题,中科院长春应用化学研究所王宏达(点击查看介绍)课题组利用了一种小分子肽标记EpCAM,用直接随机光学重构显微镜(dSTORM)对EpCAM在细胞膜上的分布模式进行了超分辨成像和定量分析,并进一步阐明了EpCAM蛋白在细胞膜上的组装机理。
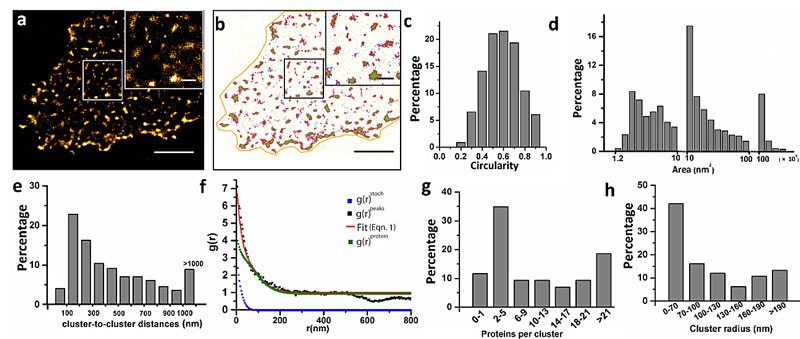
图1. EpCAM在MCF-7细胞膜上的超分辨成像及定量分析。图片来源:Anal. Chem.
在本工作中,作者选用一种高特异性的小分子肽进行标记,以获得更准确的蛋白信息。超分辨重构图显示了EpCAM蛋白是以聚集形态分布于人乳腺癌细胞(MCF-7)膜上。通过SR-Tesseler与pair-correlation function两种方法统计分析,发现这些聚集体形状大小不一,且包含不同个数的蛋白。作者进一步对EpCAM蛋白的聚集机理进行了探索,通过双色dSTORM成像EpCAM和四跨膜蛋白CD9,发现二者之间有共定位分布的空间联系。而沉默CD9基因后,EpCAM在细胞膜上的聚集程度也相应减少。不仅四跨膜蛋白区域的环境可以影响EpCAM在细胞膜上的聚集,作者还发现肌动蛋白细胞骨架和N-糖基化在EpCAM聚集体的形成中也起着重要的作用。该研究为探索EpCAM蛋白在细胞中的生物学功能提供了新的线索。
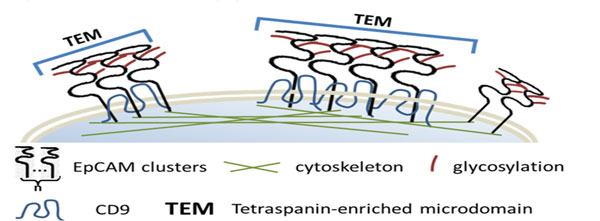
图2. EpCAM在细胞膜上的组装机理。图片来源:Anal. Chem.
该项研究得到国家重点研发计划、国家自然科学基金等支持。
这一成果近期发表在Analytical Chemistry 上,文章的第一作者是中科院长春应化所博士研究生荆莹莹,通讯作者是中科院长春应化所高婧副研究员和王宏达研究员。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Quantitatively Mapping the Assembly Pattern of EpCAM on Cell Membranes with Peptide Probes
Yingying Jing, Lulu Zhou, Junling Chen, Haijiao Xu, Jiayin Sun, Mingjun Cai, Junguang Jiang, Jing Gao,* Hongda Wang*
Anal. Chem., 2020, 92, 1865-1873, DOI: 10.1021/acs.analchem.9b03901
导师介绍
王宏达
https://www.x-mol.com/university/faculty/15787
 0
0











