在现代有机合成中,C(sp3)–H键活化作为一种原子经济性的策略,极大地促进了物质制备。经过数十年的发展,合成化学家逐渐认识到C(sp3)–H键活化最理想的状态应该是利用底物本身的功能性质形成瞬态环金属过渡态来实现反应性和选择性,从而摒弃略显“笨拙”的导向基团。虽然目前有少量例子(如羧酸、伯胺、仲胺)能实现这一过程,但更多的情况是一种称为“辅基增强的C(sp3)–H键活化策略”(auxiliary-augmented C(sp3)–H activation strategies),即需要额外添加导向基以调节底物的配位能力,从而实现Pd(II)催化的C(sp3)–H键活化过程。但是,这种策略仍存在一定的局限性:第一,必须在C-H键断裂前将导向基安装在底物上;第二,导向基脱保护的条件比较苛刻;第三,如果底物上无法添加导向基(例如烷基叔胺),就无法实现这一过程。
据统计,约26%的药物和农药中含有烷基叔胺结构。因此,开发一种一步到位且选择性高的C(sp3)–H键活化方法,无疑给这些药物分子的结构修饰带来巨大的便利,这也是方法学研究者追逐的一个方向。不过这方面的研究仍颇具挑战,因为烷基叔胺中的氮原子富电子,在过渡金属和常用的氧化剂作用下易分解。目前只有少量的研究涉及这方面。例如,Hartwig团队利用位阻效应实现Rh-、Ru-、Ir-催化的烷基叔胺上甲基的C(sp3)–H硼化反应(J. Am. Chem. Soc., 2004, 126, 15334–15335; J. Am. Chem. Soc., 2006, 128, 13684–13685; J. Am. Chem. Soc., 2014, 136, 8755–8765),其中一些例子可以实现β-位选择性硼化;而远程的C(sp3)–H键虽然可以在Pt-、Ru-、Fe-或W-催化下氧化(J. Am. Chem. Soc., 2015, 137, 12796–12799; J. Am. Chem. Soc., 2017, 139, 9503–9506; J. Am. Chem. Soc., 2015, 137, 14590–14593; Angew. Chem. Int. Ed., 2017, 56, 15274–15278),但通常需要强酸性条件,且这些转化依赖于C-H键的反应性,而与叔胺的导向作用无关。总的来说,目前还没有报道过烷基叔胺导向的C(sp3)–H官能团化。在这个背景下,近日剑桥大学Matthew J. Gaunt教授(点击查看介绍)团队巧妙设计催化体系,以非天然氨基酸作为配体,醋酸钯为催化剂,叔胺作为导向基团通过形成五元环钯中间体,实现了烷基叔胺γ-C(sp3)–H芳基化并具有较高的对映选择性,相关工作发表在Nature Chemistry 上。
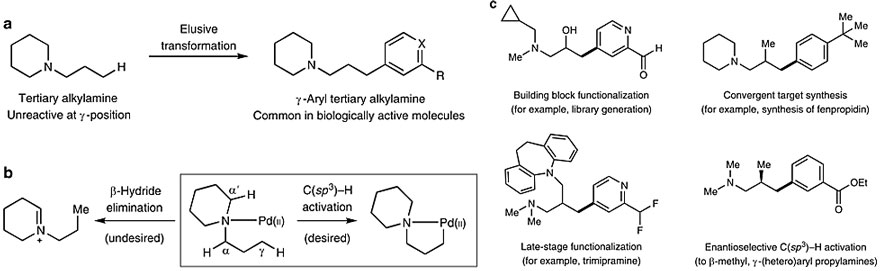
烷基叔胺γ-C(sp3)–H键活化设想。图片来源:Nat. Chem.
如上所述,实现烷基叔胺γ-C(sp3)–H芳基化的前提是要通过叔胺的配位作用形成五元环钯中间体。尽管,早在1985年Ryabov等人就认为N,N-二甲基苄胺可以与Pd(II)形成五元环钯中间体(J. Chem. Soc. Dalton Trans., 1985, 12, 2629–2638),但推广到烷基叔胺上,发现这种环钯中间体被过多的C-H键包围,很可能发生不利的β-H消除反应。因此,起初作者用烷基叔胺1a和苯硼酸2a在醋酸钯催化下进行反应,并未得到芳基化产物,而是叔胺分解的产物。这也与计算结果一致:醋酸根协助的β-H消除过渡态Ts2的能量要比C(sp3)–H键活化过渡态Ts1低(下图a)。是否可以引入配体来翻转这两种过渡态的能量呢?2014年,余金权课题组发现在N-乙酰基-α-氨基酸的作用下,N-烷基磺酰胺可与芳基硼酸酯实现C(sp3)–H芳基化,而没有该配体时反应则不能发生(Nat. Chem., 2014, 6, 146–150)。这就提示,N-乙酰基-α-氨基酸能促进C(sp3)–H键活化。作者通过计算发现,在N-乙酰基叔丁基-亮氨酸4a的存在下,β-H消除的过渡态TS4的共平面性被打破,而碱协助的C(sp3)–H键活化过渡态TS3相对更有利,再经过C(sp3)–H键活化中间体Int-I转化为环钯中间体Int-II后,通过转金属化转化为Int-III,最后还原消除实现γ-C(sp3)–H芳基化。实验结果也证实这点:在Pd(OAc)2/4a催化体系下,1a可以顺利地转化为γ-C(sp3)–H芳基化产物3a(产率:81%)。
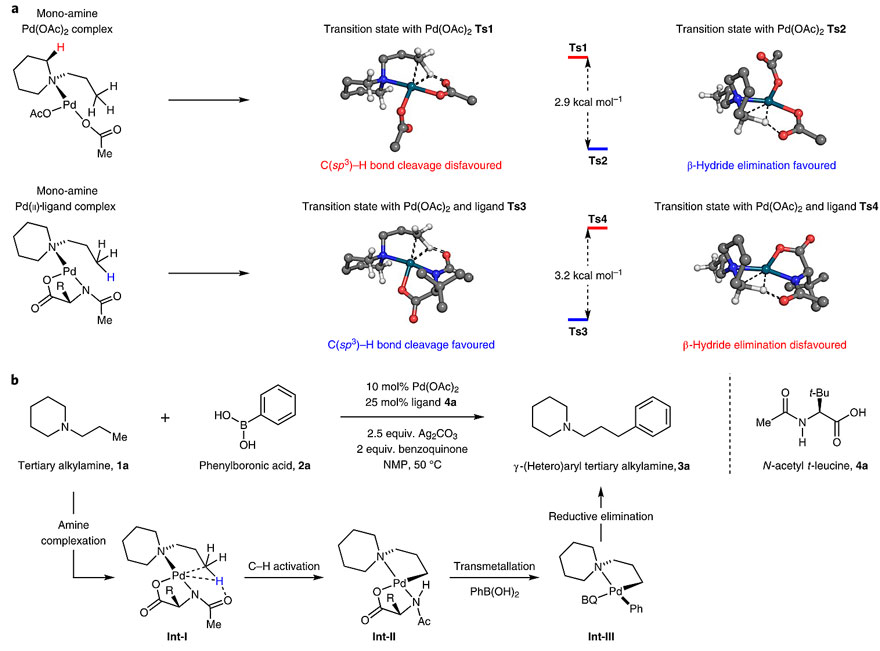
氨基酸加速的烷基叔胺γ-C(sp3)–H键活化设想及实验验证。图片来源:Nat. Chem.
在最优条件下,作者进行了底物扩展。如下图所示,N-杂环上不同的取代基都能兼容该反应,以良好的收率得到目标产物(3a-3m),其中γ-芳基化产物(3h-3j)是药物分子和农用化学品中间体的结构片段。另外,该反应也可以发生在哌啶环上的2-乙基取代基,以中等的收率生成3n。有趣的是,底物1o在杂环的3-甲基上发生芳基化反应,生成3-苄基-哌啶衍生物3o。其他饱和杂环也能实现γ-C(sp3)-H芳基化反应(3p-3s)。链状的烷基叔胺也能实现γ- C(sp3)-H芳基化反应,例如N,N-二甲基衍生的烷基叔胺最多有8个与氮原子相邻的C-H键,这意味着特别容易发生消除。值得注意的是,一系列N,N-二烷基胺衍生物都能以中等至较高的收率形成胺(3u-3ac),其中α-和β-取代的底物也能兼容该反应(3v-3y)。接下来,作者考察了芳基硼酸的底物范围。不论是对位还是间位带有给电子或吸电子基团,都能以高收率形成γ-芳基烷基胺(3ad-3am),包括对钯敏感的官能团(如芳基溴化物3ag、3ah);然而,邻位取代的芳基硼酸的收率则较低(3an)。此外,杂芳基硼酸(如官能化吡啶和吲哚)都能够进行这一转化(3ao-3ar),从而实现后续的结构修饰。
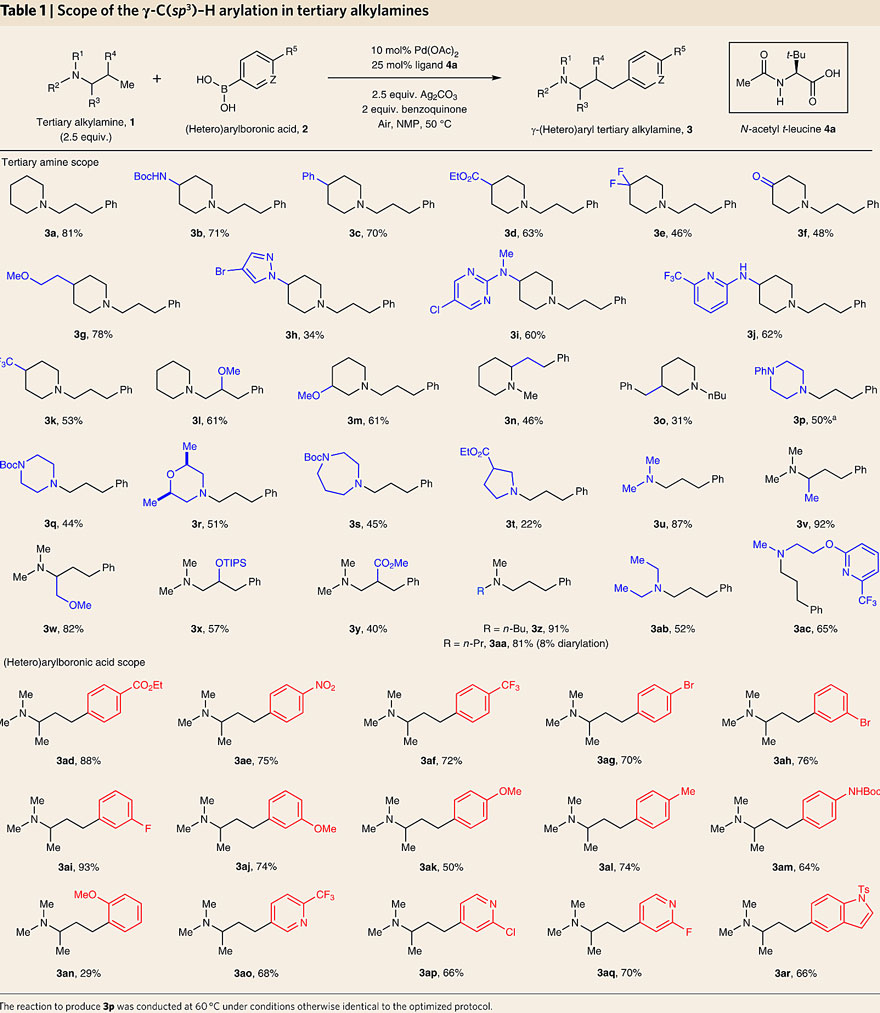
烷基叔胺γ-C(sp3)–H芳基化底物扩展。图片来源:Nat. Chem.
上文已经提到很多药物中都含有烷基叔胺结构,于是作者便用该策略对几种药物进行合成或修饰。例如,可以将中间体1ad和硼酸2p一步制备农药丁苯吗啉5(下图a);对乙酰胆碱酯酶抑制剂多奈哌齐、抗生素环丙沙星及抗抑郁药氟西汀和丙咪嗪都可以进行γ-C(sp3)–H芳基化修饰(6-9),这些结果证实了其在药物后期功能化中的应用潜力。
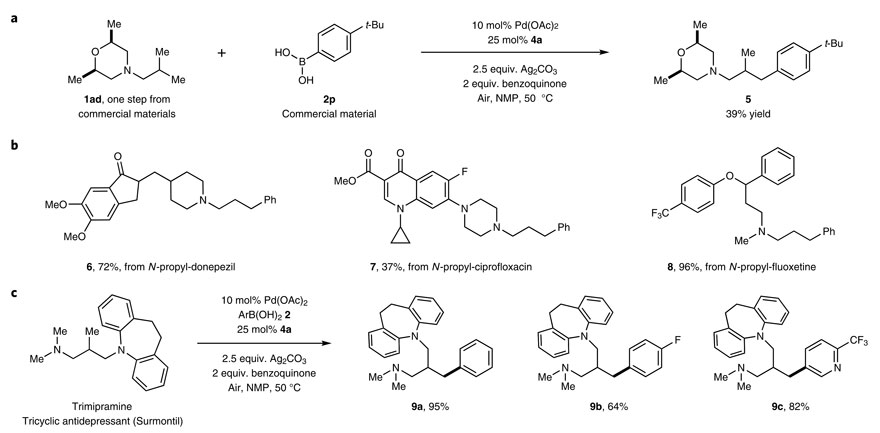
在药物合成或后期修饰中的应用。图片来源:Nat. Chem.
既然手性氨基酸配体在该反应中扮演着关键角色,那能否实现手性诱导呢,比如通过过渡态区别N-异丙基上两个完全相同的甲基实现去对称化呢?带着这些问题,作者进行了计算研究。他们认为C(sp3)–H键存在一种椅式过渡态,参与C-H键活化的甲基应与配体上乙酰基的O接近,而未反应的甲基处于平伏键时能量相对更低(TS5),否则会与N-Me产生1,3-直立键相互作用(TS6),但无论哪种情况异丙基上两个甲基都可以被配体区别开。实验证实含有异丁基的烷基叔胺与一系列的芳基硼酸在Pd(OAc)2/4a催化下能以较好的ee 值得到γ-C(sp3)–H芳基化产物(3as-3ax)。另外,环状二甲氨基衍生物10上的亚甲基C-H键也能实现γ-C(sp3)–H芳基化。
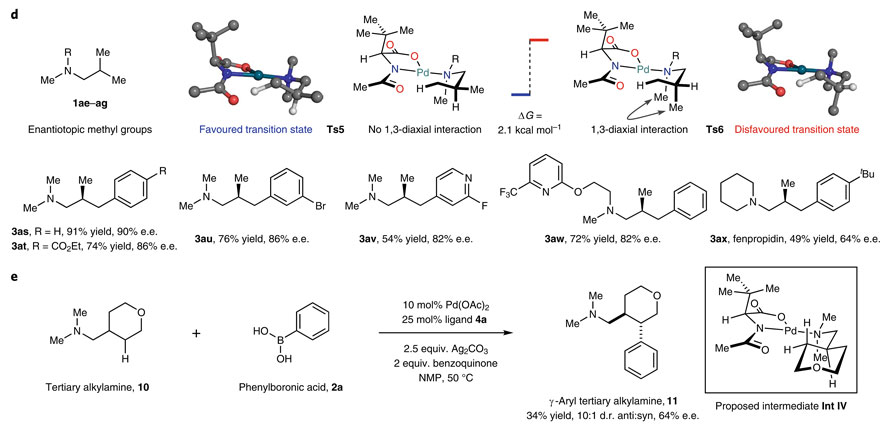
对映选择性。图片来源:Nat. Chem.
总结
Matthew J. Gaunt教授课题组发展了一种配体加速的烷基叔胺γ-C(sp3)–H芳基化方法,该反应条件温和,底物适用性广,不论是简单的底物还是复杂的分子,都可以实现这一过程。此外,在手性氨基酸配体的作用下,也可以实现烷基叔胺的不对称γ-C(sp3)–H芳基化,为含有烷基叔胺的药物分子的合成或后期修饰提供了一种强有力的工具。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Catalytic C(sp3)–H bond activation in tertiary alkylamines.
Jesus Rodrigalvarez, Manuel Nappi , Hiroki Azuma, Nils J. Flodén, Matthew E. Burns, Matthew J. Gaunt
Nat. Chem., 2020, 12, 76-81, DOI:10.1038/s41557-019-0393-8
导师介绍
Matthew J. Gaunt
https://www.x-mol.com/university/faculty/2561
(本文由峰千朵供稿)
 0
0












