目前,光治疗(光热治疗和光动力治疗)是一种具有临床前景的新兴癌症治疗方法,虽然具有侵袭性低、选择性清除等优势,但是肿瘤的乏氧微环境、光敏剂固有的毒性、单一光治疗效果的局限性等严重限制了其临床转化的进程。此外,基于纳米载药体系所引发的脱靶效应导致的全身毒性和长期毒性是需要研究者们注意的。
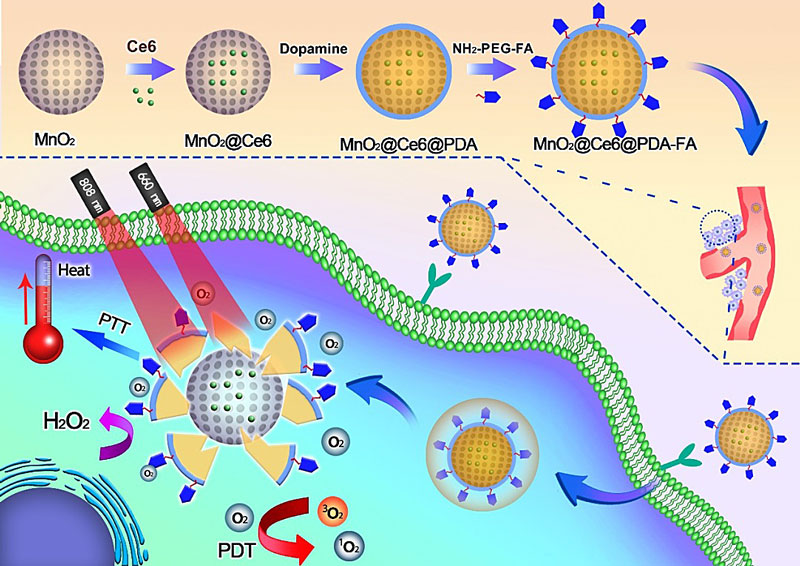
聚多巴胺是一种贻贝仿生类材料,可由多巴胺在弱碱性环境下自聚而得。聚多巴胺具有诸多优良特性,例如简单的制备方法,良好的生物相容性以及优异的光热特性等。聚多巴胺具备优良的近红外光热转换功能,可用于肿瘤的光热治疗。聚多巴胺在材料表面改性、生物检测和成像以及纳米医学等领域拥有广阔的应用前景。针对肿瘤组织呈现的独特微酸性微环境和光治疗中激光的可选择性和可控性,中山大学药学院(深圳)梅林教授(点击查看介绍)和曾小伟副教授(点击查看介绍)构建了一种聚多巴胺和叶酸修饰的pH/光双响应中空介孔二氧化锰纳米载药体系用于肿瘤光热-光动力联合治疗,实现清除肿瘤的目的。该纳米体系在EPR效应和叶酸介导的主动靶向作用下,精确达到肿瘤部位,极大减少了毒性。在肿瘤微酸环境下,外层的聚多巴胺首先解聚从而释放光敏剂,然后暴露的中空介孔二氧化锰和肿瘤过表达的过氧化氢反应提供氧气,最后在660 nm激光刺激下,实现氧气促进的光动力治疗。有趣的是,光热材料聚多巴胺和二氧化锰核壳结构在808 nm激光刺激下,具有热累积效应,进一步烧灼肿瘤。该纳米载体具有良好的生物相容性,在肿瘤的联合治疗领域具有潜在的应用价值。
这一成果近期发表在国际顶尖期刊Chemical Engineering Journal 上,文章的共同第一作者是中山大学博士研究生曾伟伟和硕士研究生张涵洁,通讯作者为中山大学梅林教授、曾小伟副教授和姬晓元博士。本研究获得国家自然科学基金、深圳市科创委和中央高校基本科研业务费等经费的支持。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Dual-response oxygen-generating MnO2 nanoparticles with polydopamine modification for combined photothermal-photodynamic therapy
Weiwei Zeng, Hanjie Zhang, Yimin Deng, Aiting Jiang, Xiaoyan Bao, Minqi Guo,
Zimu Li, Meiying Wu, Xiaoyuan Ji*, Xiaowei Zeng*, Lin Mei*
Chem. Eng. J., 2020, 389, 124494, DOI: 10.1016/j.cej.2020.124494
导师介绍
梅林
https://www.x-mol.com/university/faculty/50085
曾小伟
https://www.x-mol.com/university/faculty/69051
 0
0












