英文原题:Self-Delivery Nanomedicine for O2‑Economized Photodynamic Tumor Therapy
通讯作者:余细勇(广州医科大学),成红(南方医科大学),李仕颖(广州医科大学)
作者:Lin-Ping Zhao, Rong-Rong Zheng, Hua-Qing Chen, Ling-Shan Liu, Xiao-Ya Zhao, Hou-He Liu, Xiao-Zhong Qiu, Xi-Yong Yu,* Hong Cheng,* Shi-Ying Li*
光动力学治疗具有高效可控、非侵入等特点,在纳米药物和抗肿瘤相关研究中受到广泛关注。然而,光动力学治疗使用的光敏剂缺乏肿瘤靶向性和特异性,肿瘤细胞异常增殖造成的乏氧微环境,又进一步抑制了氧依赖光动力学疗法的抗肿瘤疗效。尽管药物载体可以提升光敏剂的靶向性,但药物载体的生物安全性和免疫原性等问题,极大的限制了光动力学纳米药物的应用。通过药物自组装构建自传递纳米药物,能够赋予抗肿瘤药物独特的纳米生物学特性,也避免了药物载体带来的诸多问题,但药物特定的分子结构限制了药物的自组装行为。
近日,广州医科大学余细勇教授、李仕颖研究员与南方医科大学成红副教授课题组共同合作,设计和制备了基于光敏剂(Ce6)和线粒体呼吸链抑制剂(ATO)的自组装节氧型-自传递光动力学抗肿瘤纳米药物(ACSN),通过线粒体呼吸抑制能够有效的降低肿瘤细胞的氧消耗,进而改善乏氧条件下光敏剂的光动力学疗效(图1)。
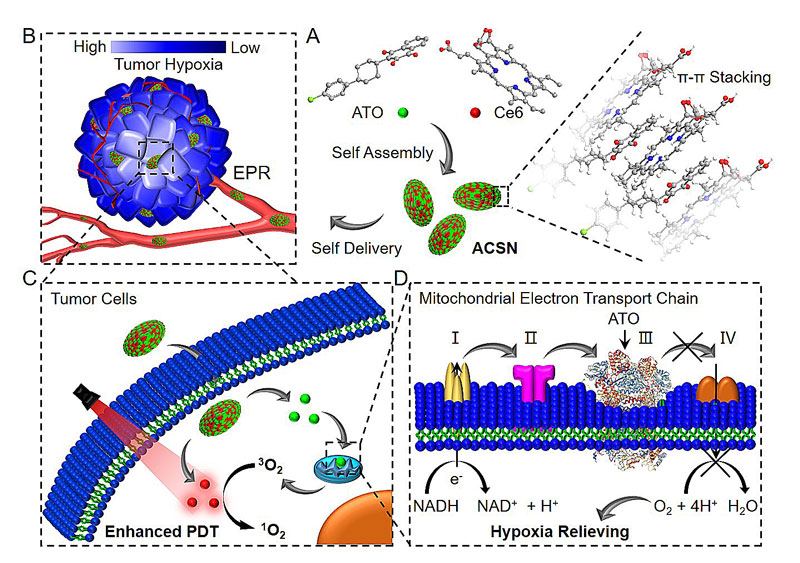
图1. 节氧型自传递纳米药物抑制线粒体呼吸增强光动力学疗效机制
研究发现,通过调节Ce6与ATO能够通过π-π相互作用实现药物自组装,通过调整药物比例能够实现组装结构的精准调控,得到的均一分散的纳米药物能够在长时间内保持稳定(图2)。与此同时,该纳米药物能够提升Ce6和ATO跨膜转运和肿瘤深度穿透的特性(图3),极大的提升了该纳米药物在乏氧改善和光动力学增强的抗肿瘤应用潜力。该纳米药物具有良好的肿瘤靶向行为,并且通过线粒体呼吸抑制实现肿瘤乏氧微环境的改造,展现出良好的肿瘤生长抑制效果和良好的生物安全性(图4)。
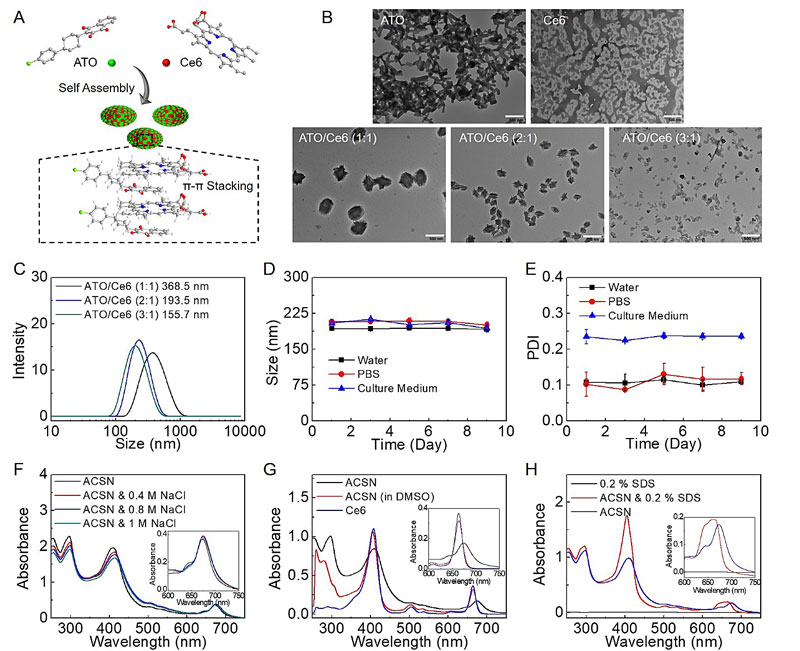
图2. 自组装纳米药物的制备及表征

图3. 细胞内吞和肿瘤穿透性能

图4. 肿瘤靶向、肿瘤生长抑制和生物安全性评估
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Self-Delivery Nanomedicine for O2-Economized Photodynamic Tumor Therapy
Lin-Ping Zhao, Rong-Rong Zheng, Hua-Qing Chen, Ling-Shan Liu, Xiao-Ya Zhao, Hou-He Liu, Xiao-Zhong Qiu, Xi-Yong Yu*, Hong Cheng*, Shi-Ying Li*
Nano Lett., 2020, DOI: 10.1021/acs.nanolett.0c00047
Publication Date: February 25, 2020
Copyright © 2020 American Chemical Society
导师介绍
余细勇
https://www.x-mol.com/university/faculty/59871
李仕颖
https://www.x-mol.com/university/faculty/59890
成红
https://www.x-mol.com/university/faculty/105286
(本稿件来自ACS Publications)
 0
0