向有机化合物中引入多氟烷基取代基在制药和农业化学工业中具有重要的作用。例如,CF3独特的位阻和电性会影响候选药物的代谢稳定性、结合亲和力、溶解性和亲脂性。另外,三氟甲基化立体中心也存在于许多先导化合物和市售药物中。然而,引入三氟甲基化立性中心的方法通常可分为两大类:1)将CF3基团直接对映选择性地安装在前手性底物上(图1a)。目前,化学家已经开发了几种CF3传递试剂和催化体系,并且已经开发了不同的反应模式(亲电、亲核、自由基反应)。2)含有前手性CF3底物的不对称官能化。常见的策略是将亲核试剂加成到缺电子的底物上,如三氟甲基化的羰基化合物、亚胺和Michael受体(图1b)。另一种策略是将三氟甲基的α-碳直接去质子化,然后用亲电试剂捕获(图1c),但是会伴有β-氟消除。
迄今为止,仅报道过几例β-氟碳负离子作为亲核试剂的反应(Angew. Chem. Int. Ed., 1986, 25, 98–99; J. Org. Chem., 1999, 64, 8369–8374; J. Am. Chem. Soc.,2004, 126, 13174–13175),并且在不对称催化领域中更为罕见。美国斯坦福大学的Barry M. Trost教授(点击查看介绍)课题组设想能否发展一种替代策略,既可以防止β-氟消除,又可以避免使用强吸电子和含杂原子的稳定基团?近日,他们通过相邻阳离子π-烯丙基钯络合物来稳定α-CF3碳负离子,使其能够和一系列的受体(如硝基烯烃、亚胺、羰基化合物)发生不对称的[3+2]环加成反应。相关成果发表在Nature Chemistry 上。
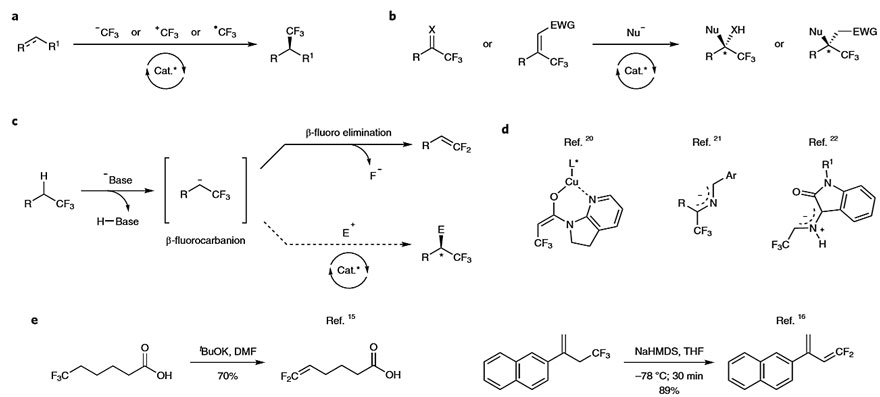
图1. 现有的用于构建手性三氟甲基碳的不对称催化策略。图片来源:Nat. Chem.
先前曾报道过钯-三亚甲基甲烷(TMM)配合物和其他钯稳定的两性离子在环加成反应中的应用。Pd–TMM两性离子中间体的形成主要是由阳离子钯π-烯丙基络合物的独特电荷分布驱动的,其中心上的碳可以稳定通过脱硅化或直接去质子化产生的邻近碳负离子(图2a)。受此启发,作者设想将Pd-烯丙基置于β-氟代碳负离子邻位是否会阻止氟的消除。因此,他们设计了双功能底物1,该底物同时包含碳酸烯丙酯和α-CF3亚甲基单元(图2b)。一旦将化合物1暴露于合适的Pd(0)络合物,碳酸烯丙酯就会离子化,生成Pd-烯丙基络合物2并释放出碳酸根负离子。然后原位生成的碱将攫取α-CF3质子,如果β-氟碳负离子确实稳定并具有适当的寿命,那么生成的两性离子3可能会发生环加成反应,从而生成有价值的多氟烷基取代的碳环和杂环化合物(图2d)。
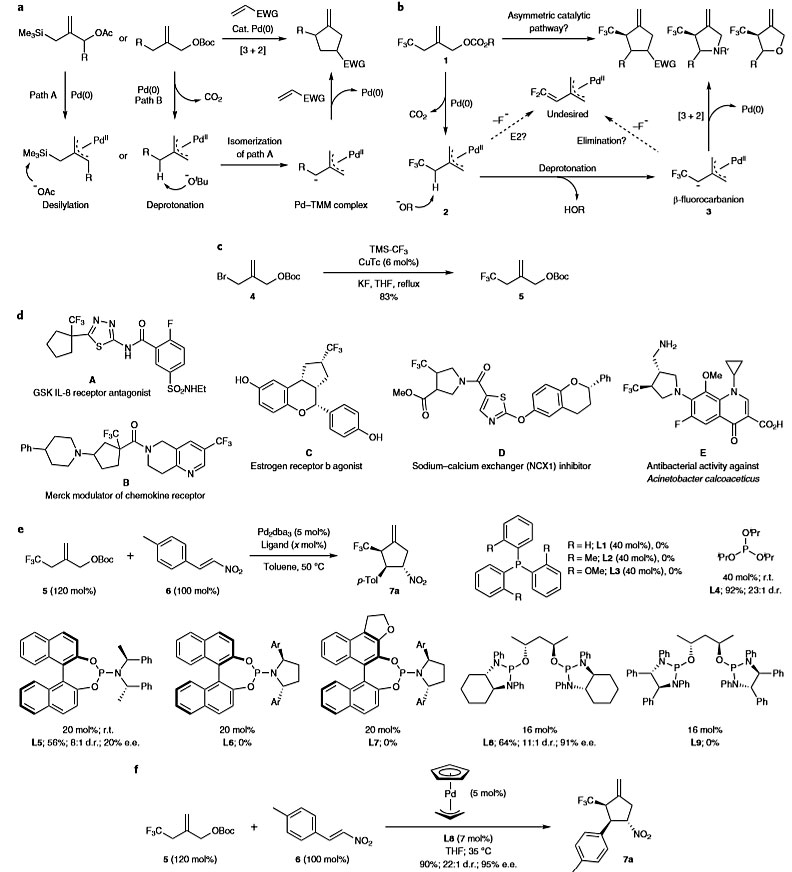
图2. 稳定和利用α-CF3碳负离子进行不对称环加成反应的可能策略。图片来源:Nat. Chem.
作者通过铜催化的三氟甲基化,从简单易得的溴化物4高效地合成了双官能碳酸烯丙酯5(图2c)。随后,使用Pd2(dba)3作为预催化剂,硝基烯烃6为受体,对反应条件进行了优化,结果表明配体对该过程至关重要(图2e)。简单的三苯基膦L1及其衍生物(L2-L3)均无法获得所需的产物7a。当使用亚磷酸三异丙酯L4时,反应活性显著增加,以92%的收率、23∶1的d.r.值获得所需产物7a。为了实现对映选择性,作者考察了几种与L4具有相当性质的手性配体。市售的亚磷酰胺L5能以56%的收率、20%的e.e.值得到7a,而使用位阻更大、刚性更强的L6和L7则会抑制反应。值得注意的是,先前在TMM环加成反应中使用的L8能显著提高该反应的对映选择性(91% e.e.值),而位阻较大的衍生物L9则会抑制反应。最后,使用PdCp烯丙基作为预催化剂,四氢呋喃作为溶剂,在35 ℃下进行反应,以90%的收率、22:1 的d.r.值、95%的e.e.值获得产物7a。
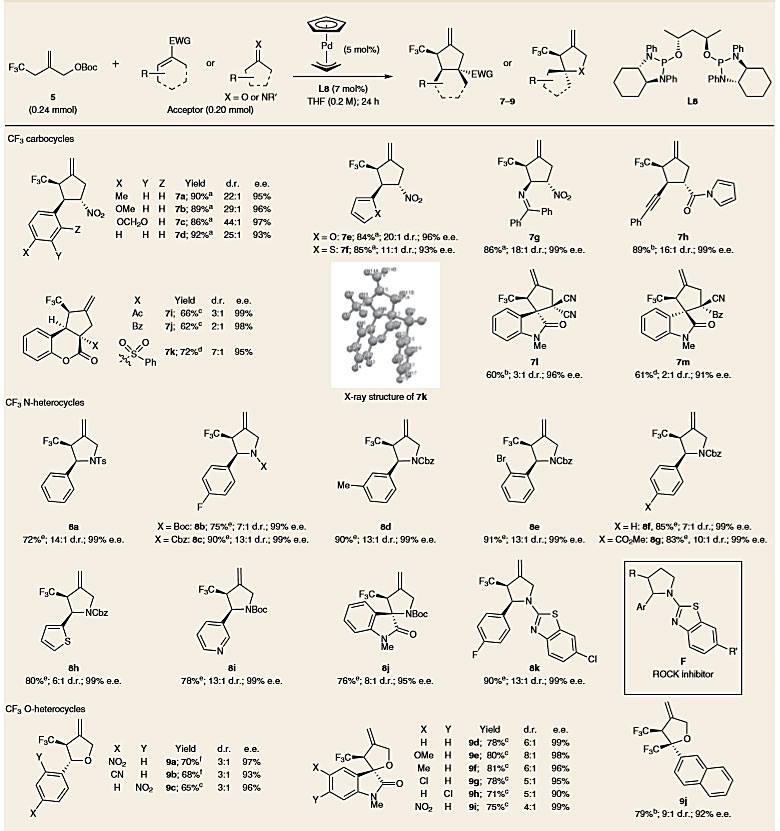
图3. 与不同受体的不对称环加成反应。图片来源:Nat. Chem.
在最佳反应条件下,作者考察了该反应的底物范围(图3)。首先是硝基烯烃类受体,具有不同位阻和电性的硝基苯乙烯都可参与该反应,并以优异的收率、非对映选择性和对映选择性得到环加合物(7a–7d)。值得一提的是,杂芳族化合物如呋喃(7e)、噻吩(7f)也能兼容该反应。二苯亚胺取代的底物也能以86%的收率、18:1的 d.r. 值和99%的e.e. 值得到7g。除硝基烯烃外,其他缺电子烯烃也能兼容该反应,例如香豆素和α,β-不饱和酰基吡咯,生成具有连续手性中心的三氟甲基取代的碳环化合物(7h-7k)。四取代的3-亚烷基氧化吲哚也能以优异的对映选择性生成带有两个邻位季碳立体中心的产物(7l、7m)。
鉴于三氟甲基化吡咯烷存在于多种生物活性化合物中(图2b),于是作者研究亚胺类受体。通常在[3+2]环加成反应中,具有各种正交保护基的亚胺(如Boc、Cbz、Ts)都能兼容该反应,能以99%的e.e. 值生成CF3取代的吡咯烷(8a–8c)。不同位阻和电性取代的芳族和杂芳族化合物均具有良好的耐受性(8d–8i)。此外,尽管靛红衍生的酮亚胺的位阻更大,但仍能以76%的收率和95%的e.e.值得到相应的具有四取代立体中心的CF3取代的吡咯烷8j。利用N-杂芳族亚胺生成的8k能够实现Rho相关的蛋白激酶抑制剂E的CF3取代类似物的合成。
除亚胺外,羰基化合物也可作为偶联体。尽管与其他受体相比具有较低的非对映选择性,但几种缺电子醛仍能以优异的对映选择性得到CF3取代的四氢呋喃(9a–9c)。有趣的是,与亚胺和硝基烯烃不同,醛得到的主要非对映异构体是反式加合物,这表明在过渡态期间底物的方向发生了变化。一系列N-甲基靛红也能用于该反应,生成含有四取代手性中心的四氢呋喃(9d-9i)。最后,使用大位阻的三氟甲基芳基酮作为受体,以92%的e.e.值、9:1的d.r.值得到两个邻位手性CF3取代的产物9j。然而,诸如苯乙酮和丙酮之类的简单酮则不反应。
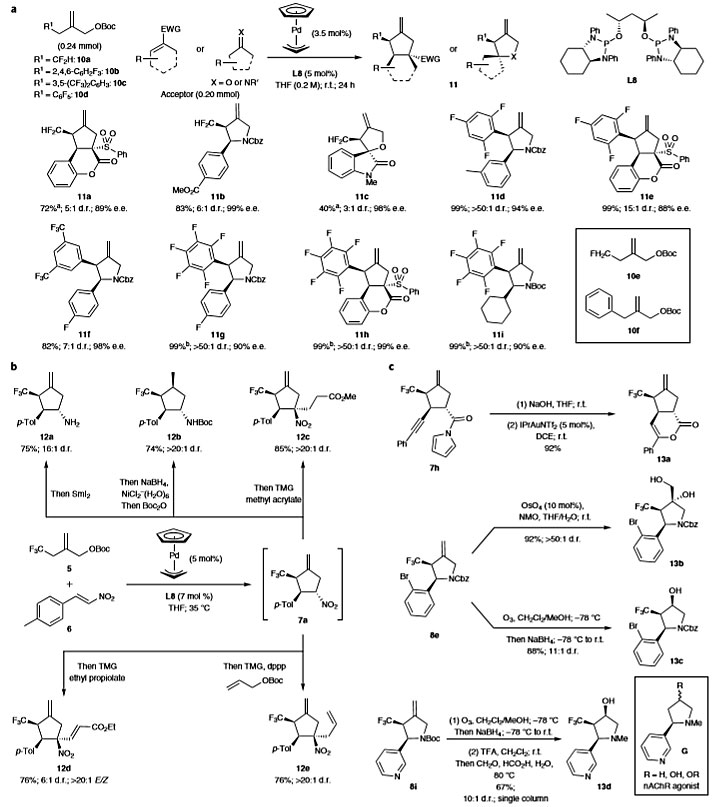
图4. 底物范围及合成应用。图片来源:Nat. Chem.
为了进一步扩大该方法的普适性,作者评估了对药物研发具有潜在重要性的其他氟化取代基(图4)。二氟甲基可作为亲脂性氢键供体,使其成为羟基、硫醇、氨基的潜在生物等排体。尽管CF2H的吸电子性比CF3弱,但10a仍是合适的环加成底物。生成的α-二氟甲基碳负离子可与各种受体偶联,以优异的对映选择性得到手性二氟甲基取代的环戊烷11a、吡咯烷11b和四氢呋喃11c。立体选择性略有降低的原因可能是由于CF2H相对于CF3较小的尺寸和较低的电负性,导致不太有效的手性识别。然而,单氟甲基取代的供体10e反应得到复杂的混合物,这可能是由于相邻质子的pKa较高。除氟代烷基取代基外,氟代芳基取代基也能兼容该反应,例如2,4,6-三氟苯基10b、3,5-双三氟甲基苯基10c、五氟苯基10d,以高达99%的产率和99%的e.e.值得到多氟芳基取代的碳环和杂环化合物(11d–11i)。相反,苯基取代的底物10f不能得到所需的产物,这可能是由于其相比氟化物吸电子性能差。
随后,作者通过一锅法实现了7a的后续转化。将SmI2加入粗反应混合物中,可选择性地还原成伯胺12a;当使用NaBH4和NiCl2(II)时,可生成具有四个连续立体中心的CF3取代的环戊基胺12b;此外,用四甲基胍作为碱,可实现7a与丙烯酸酯以及丙炔酸酯的1,4-加成反应,得到含有四取代的α-硝基碳环化合物(12c、12d);值得一提的是,最初环加成产生的钯还可用于随后的烯丙基烷基化反应,以76%的收率、> 20:1 的d.r.值生成12e。此外,7h水解后发生6-endo-dig环化,得到双环产物13a。8e通过Upjohn双羟化得到单一的非对映异构体13b;通过臭氧化、NaBH4还原得到仲醇13c。将8i上的烯烃转化为仲醇后,用TFA脱掉Boc,然后一锅法进行Eschweiler-Clarke甲基化反应,以67%的总收率得到吡咯烷产物13d,为烟酰胺基乙酰胆碱受体拮抗剂的CF3取代的类似物提供了一种高效且简便的途径。
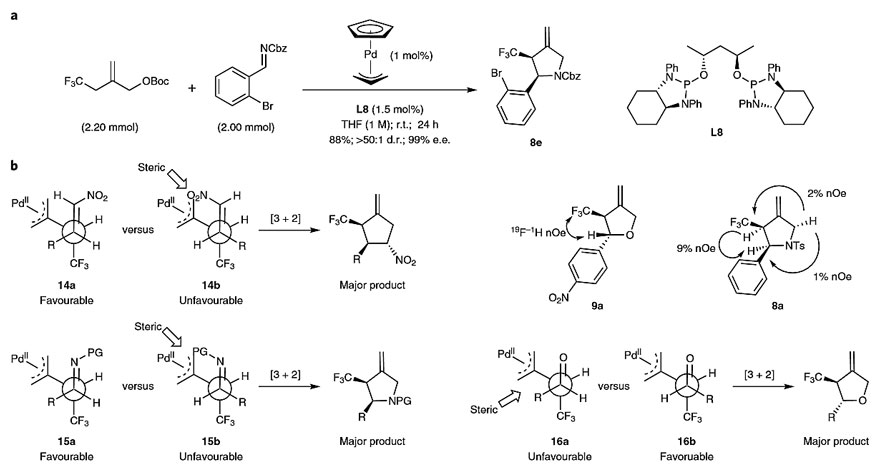
图5. 毫摩尔级反应及可能的过渡态。图片来源:Nat. Chem.
另外,当用1 mol%的预催化剂和1.5 mol%的L8进行2 mmol规模的反应,能以88%的收率得到单一异构体8e(图5a)。为了合理解释反应的立体化学结果,作者提出了基于NOE研究和X-射线晶体学分析的模型(图5b)。在形成钯稳定的两性离子后,受体参与反应循环,同时将大位阻Pd-配体络合物的空间位阻降至最小。在硝基烯烃和亚胺的情况下,过渡态14a和15a在能量上更有利,因为庞大的硝基和N-保护基背离钯取代基,从而形成相应的顺式加合物。相反,由于羰基上没有取代基,醛采用16b作为更有利的过渡态。结果R基团和Pd-配体络合物之间的空间相互作用成了立体中心的决定因素,导致得到反式加合物。
总结
B. M. Trost课题组利用π-烯丙基钯络合物的独特电荷分布生成相邻的α-CF3碳负离子,可实现不对称[3+2]环加成反应。与以前的体系相比,该策略不依赖羰基或亚胺来防止β-氟消除,还可以使用各种各样的受体,并且高效和立体选择性地产生有价值的CF3取代的五元环,同时还成功地引入其他多氟取代基。另外,催化过程的温和条件允许在粗反应混合物上进行原位转化,环外烯烃的存在也为进一步的结构修饰提供了有力的手段。由于氟化官能团的独特性质,该合成方法有望用于新药和农用化学品的研发中。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Use of α-trifluoromethyl carbanions for palladium-catalysed asymmetric cycloadditions
Barry M. Trost , Youliang Wang, Chao-I (Joey) Hung
Nat. Chem., 2020, 12, 294-301, DOI:10.1038/s41557-019-0412-9
导师介绍
Barry M. Trost
https://www.x-mol.com/university/faculty/433
 0
0










