化疗是治疗癌症的主要手段之一,铂类药物的发现和应用对癌症化疗的发展具有里程碑式的意义。据统计,大约50%的临床肿瘤治疗方案中包含有铂类药物。尽管如此,铂类药物由于靶向性差、生物利用度低、体内易失活等原因,在临床使用中也存在一些问题,尤其是耐药性严重制约了它们的疗效和长期使用。很多肿瘤对铂类药物具有先天耐药性,例如顺铂对常见的胃肠道肿瘤疗效不佳。即使对铂类药物有良好响应的肿瘤,随着使用时间和剂量的累积,也容易出现获得性耐药性,进而导致治疗失败。因此,克服耐药性是铂类抗癌药物亟待解决的重要问题。一般认为,细胞核DNA是铂类药物的主要作用靶点。药物进入细胞后与DNA共价结合形成Pt-DNA加合物,被损伤的DNA不能正常转录和复制,进而激活多种信号通路导致细胞凋亡。因此,如果铂(II)损伤DNA过程受到抑制,细胞凋亡倾向就会减弱,从而导致肿瘤出现耐药性。
铂类药物遇到的首要挑战是细胞内存在一系列精密高效的DNA损伤修复系统,比如由BRCA蛋白参与的DNA双链断裂同源重组(HR)修复机制等。肿瘤细胞的DNA修复功能尤其强大,能够充分修复化疗药物引起的DNA损伤,这是铂类药物容易出现耐药性的重要原因之一。根据目前普遍接受的铂类药物作用机理,铂(II)损伤DNA达到一定程度就会触发凋亡信号转导通路,迫使细胞进入凋亡过程。但是肿瘤细胞内的DNA修复蛋白,例如参与同源重组修复的BRCA1/2、RAD51等等,会很快识别受损伤的DNA,并通过某种途径使其结构恢复原样,从而削弱铂(II)对DNA链的损伤,不能实现诱导细胞凋亡的目的。另一方面,抗凋亡蛋白的异常表达也能抵抗由DNA损伤诱导的细胞死亡。因此,DNA损伤修复机制和抗凋亡蛋白过度活化是肿瘤细胞对铂类药物产生耐药性的两个主要原因。
四价铂配合物作为新一代铂类抗肿瘤前药近年来受到人们的广泛重视,它们具有八面体空间结构,化学反应惰性大,在体内运输过程中产生的毒副反应小,而且轴向配体为功能化修饰提供了便利。一般认为,铂(IV)配合物在血浆及正常组织中保持稳定,当进入肿瘤细胞后,乏氧及高还原性环境使其还原释放出活性二价铂物种,进而损伤DNA,杀死肿瘤细胞。南京大学郭子建院士(点击查看介绍)和王晓勇教授(点击查看介绍)研究团队最近在铂(IV)轴向位置引入能抑制DNA损伤修复机制或抗凋亡蛋白的功能配体,构筑了一系列多功能四价铂前药分子,通过抑制DNA损伤修复和诱导细胞凋亡实现了克服传统铂类药物耐药性的目的。
(一)靶向同源重组修复(HR)的四价铂配合物
铂类药物进入肿瘤细胞与DNA形成交联产物,导致DNA双螺旋扭曲和复制阻滞,最终诱导DNA双链断裂和细胞凋亡。BRCA1/2是两种重要的抑癌基因,它们通过参与同源重组来修复发生双链断裂的DNA,因此,BRCA1/2突变的癌症病人对铂类药物化疗更为敏感。但是,大多数病人的BRCA功能正常,BRCA1/2突变的肿瘤病人只是少数,所以铂类药物经常表现出严重的耐药性。针对这个问题,他们设计了两个靶向HR关键蛋白RAD51的铂(IV)-青蒿素琥酯(ART)配合物(Pt-ART-I和Pt-ART-II,图1)。RAD51是HR的中心蛋白,主要由BRCA1/2招募和调控,其功能是在断裂的DNA链末端形成丝状物,进而催化链交换反应,引发HR修复。对铂类药物不敏感且具有正常BRCA功能或同源重组功能的卵巢癌和乳腺癌细胞,双取代的Pt-ART-II毒性显著高于顺铂,分别达到13倍和11倍(表1)。机制研究表明,两个化合物能够有效进入肿瘤细胞,被还原为活性二价铂物种和ART。前者与DNA结合,诱导DNA发生双链断裂,后者下调RAD51,进而抑制RAD51形成丝状物(图1,2),减弱了DNA同源重组修复能力。由于DNA双链断裂不能及时被修复,导致肿瘤细胞发生显著凋亡。结果表明在四价铂前药轴向位置引入具有下调RAD51功能的ART能够克服BRCA功能正常肿瘤细胞的耐药性,这为新型铂类药物的设计提供了有益的参考。该工作发表在Chem. Commun.。[1]
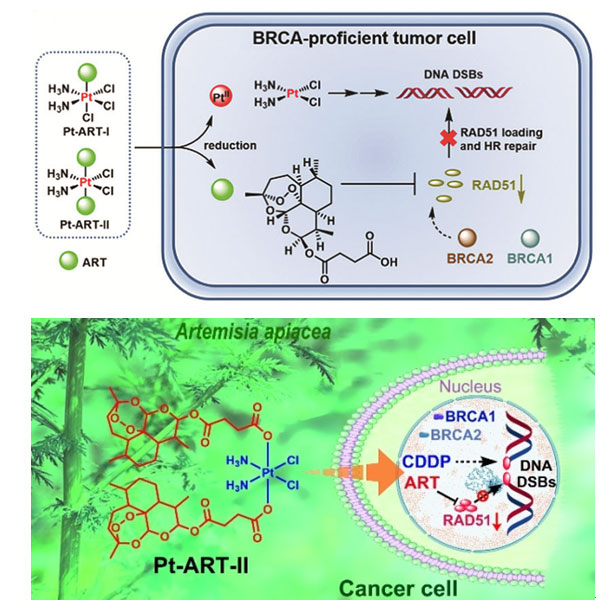
图1. Pt-ART-I和Pt-ART-II的结构及作用机理示意图
表1. Pt-ART-I和Pt-ART-II对不同细胞的IC50值(μM, 72 h)
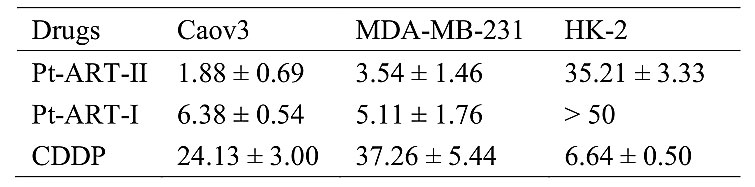
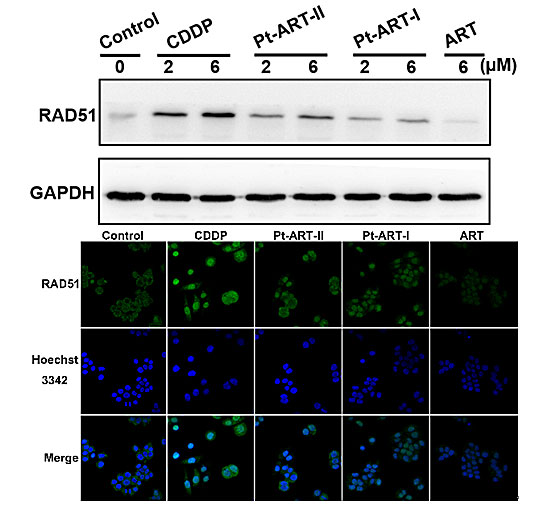
图2. 铂(IV)-青蒿素琥酯配合物对Caov3肿瘤细胞中同源重组蛋白RAD51的抑制
(二)同时靶向同源重组和凋亡逃逸的四价铂配合物
除DNA损伤修复之外,凋亡逃逸也是肿瘤细胞对铂类药物产生耐药性的重要原因,也就是说DNA修复被抑制后肿瘤细胞还可以通过激活抗凋亡途径来抵抗药物的杀伤作用,因此,要有效克服耐药性似乎应该同时干预这两条通路。Mcl-1是Bcl-2家族的一种抗凋亡蛋白,它不仅参与调控细胞凋亡,还在同源重组(HR)中扮演重要角色,因此,靶向Mcl-1也许能同时干预DNA修复和凋亡逃逸。根据这一推断,该团队设计了两个靶向Mcl-1的铂(IV)-噻吩配合物1和2(图3),它们对顺铂耐药的肺癌和卵巢癌细胞都表现出很高的毒性,其中配合物2对这两种细胞的抑制效果分别达到顺铂的32倍和61倍(表2),耐药指数(RF)也显著下降,耐顺铂的A549/DDP细胞对2和顺铂的RF分别为0.9和5.0,A2780/DDP细胞对2和顺铂的RF分别为0.7和7.23。在小鼠体内这些配合物也能够显著抑制肿瘤生长(图4),而且全身毒性较低。机理研究表明,配合物2不仅能抑制Mcl-1的表达,同时还能抑制HR蛋白RAD51和BRCA2的表达(图5),进而抑制DNA双链断裂修复,促进细胞凋亡。这些结果说明同时干预HR修复和凋亡逃逸通路能够更有效地克服耐药性,这种独特的作用机理开辟了设计抗耐药性铂类配合物的新思路。该成果发表在Chem. Sci.。[2]
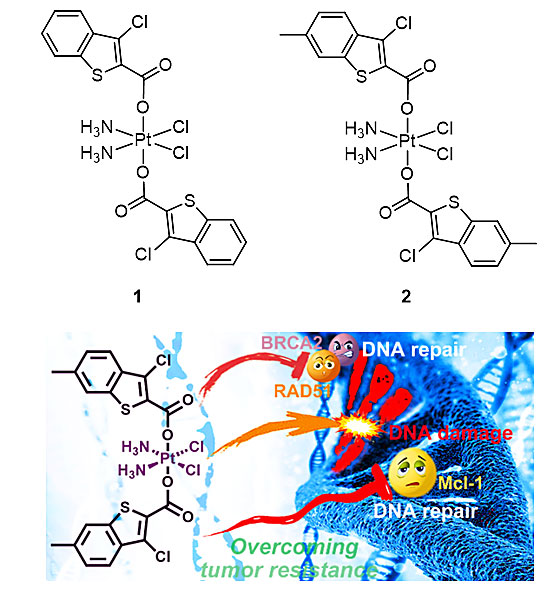
图3. 配合物1和2的结构及作用机理示意图
表2. 配合物1和2对不同肿瘤细胞的IC50值(μM,72 h)

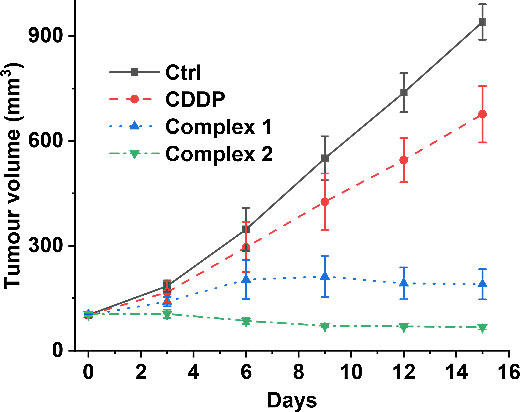
图4. 荷瘤小鼠每3天静脉注射顺铂(1.3 mg Pt kg-1)、配合物1或2(1.1 mg Pt kg-1),15天期内A549肿瘤体积的变化
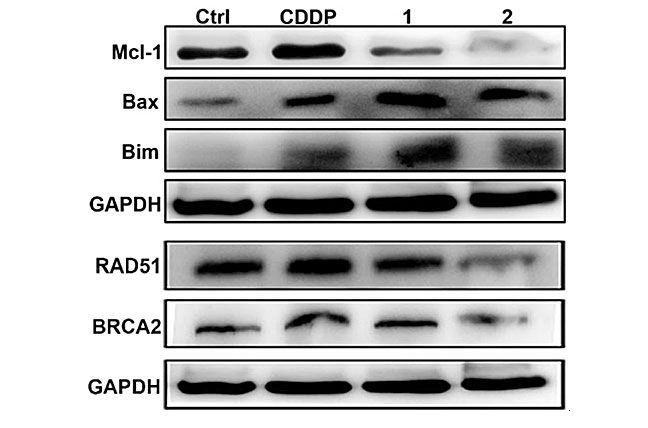
图5. 配合物1和2对A549/DDP细胞中凋亡相关蛋白和同源重组蛋白的影响
以上研究论文的第一作者是南京大学化学化工学院博士生张树人,通讯作者是王晓勇教授和郭子建院士。
1. 原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Towards rational design of RAD51-targeting prodrugs: platinumIV–artesunate conjugates with enhanced cytotoxicity against BRCA-proficient ovarian and breast cancer cells
Shuren Zhang, Hao Yuan, Yan Guo, Kun Wang, Xiaoyong Wang, Zijian Guo
Chem. Commun., 2018, 54, 11717-11720, DOI: 10.1039/c8cc06576d
2. 原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Interfering in apoptosis and DNA repair of cancer cells to conquer cisplatin resistance by platinum(IV) prodrugs
Shuren Zhang, Xuanmeng Zhong, Hao Yuan, Yan Guo, Dongfan Song, Fen Qi, Zhenzhu Zhu, Xiaoyong Wang, Zijian Guo
Chem. Sci., 2020, 11, 3829-3835, DOI: 10.1039/d0sc00197j
导师介绍
郭子建
https://www.x-mol.com/university/faculty/11597
王晓勇
https://www.x-mol.com/university/faculty/184123
 0
0












