铁是机体必不可少的一种基本元素,参与细胞内多种生理过程,如DNA复制、细胞增值、能量代谢等。细胞需维持铁稳态,机体的铁代谢紊乱将引发多种疾病。研究发现癌细胞内存在过量的铁,用以满足其不断增殖的需要。此外,大量研究还证实过多的铁与多种癌症的转移密切相关。使用去铁剂去除癌细胞内的铁,抑制癌细胞增殖和转移,已成为一种治疗癌症的新方法。目前,人们已经开发出了一系列的去铁剂,其中临床上一种主用于急性铁中毒的解毒药去铁胺(DFO),作为最常用的去铁剂,已经被用来靶肿瘤细胞内的铁治疗癌症,并已进入临床实验。然而,一般的去铁剂均存在血液循环时间短、细胞膜渗透率低、加剧肿瘤缺氧环境等不足问题,严重限制了它们的应用。
顺铂是治疗癌症最主要的化疗药之一,它主要通过形成Pt-DNA加合物,阻断DNA复制而引起细胞凋亡,最终实现抗肿瘤效果。尽管顺铂对临床上多种癌症均显示出较好的治疗功效,但它往往会伴随产生较大的毒副作用与细胞耐药性。此外,顺铂无法抑制癌细胞转移,而癌症转移是近90%的癌症患者治疗失败的主要原因。最新研究结果发现,顺铂还能通过扰乱细胞内铁代谢相关蛋白(IRP2)的表达,导致细胞内铁不足,最终促进细胞凋亡。前期研究表明,当DFO与顺铂联用时,可降低细胞内铁含量,二者产生了增强的抗肿瘤功效。因此,当前解决顺铂的临床问题,积极开发新型铂类载药体系,克服细胞顺铂耐药和有效抑制肿瘤转移,迫在眉睫。
中国科学院化学研究所肖海华研究员(点击查看介绍)团队基于前期的研究基础,设计合成了一种氧化敏感型高分子聚合物,用于包裹轴向上含吗啉和长脂肪链的四价顺铂前药,并组装成稳定的纳米载药体系纳米粒子(NPs)(图1)。该NPs能在高氧化态的肿瘤微环境中使高分子断裂、纳米粒子崩解,从而迅速释放出铂药,绕过小分子铂类药物进入癌细胞的生物屏障、增加摄取、降低解毒,从而增强细胞毒性。当NPs与去铁剂Dp44mT联合处理肿瘤细胞时,一方面,通过释放的铂药形成Pt-DNA加合物,加速细胞凋亡;另一方面,通过去除细胞内的铁,有效遏制癌细胞转移。体外与体内实验均表明该纳米四价铂能有效提高顺铂的抗癌功效,两者联用能产生增强的抗癌活性,同时有效抑制肿瘤转移。该研究首次从靶向铁代谢的角度,探讨利用纳米四价铂治疗癌症的新思路,为临床上克服顺铂耐药与抑制癌转移提供了新的视角。
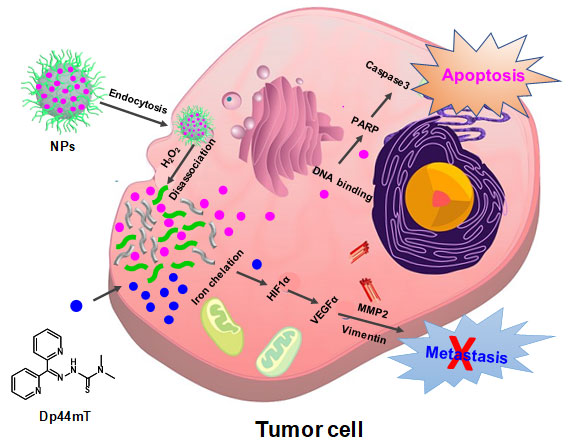
图1、纳米四价顺铂与Dp44mT联用增加顺铂抗癌效果和抗肿瘤转移的分子机制
体外细胞实验结果表明顺铂前药Pt(IV)与去铁剂Dp44mT联用能抑制多种细胞的增殖 (IC50 < 1 μM),产生更强的细胞毒性。细胞流式结果显示NPs和Dp44mT联用会导致肺癌细胞凋亡率高达62%,明显高于顺铂前药Pt(IV)和Dp44mT单独使用的效果 (分别为28%和18.5%)。此外,通过激活细胞凋亡信号通路,NPs与Dp44mT联用能诱导c-caspase3和c-PARP蛋白表达,促进细胞凋亡。同时,细胞划痕实验和Transwell实验显示,二者联用能显著抑制细胞伤口愈合与细胞迁移。以上实验证实,通过去铁剂靶向细胞铁代谢,能敏化顺铂,从而产生更好的抗癌功效,并且有效抑制细胞转移(图2)。
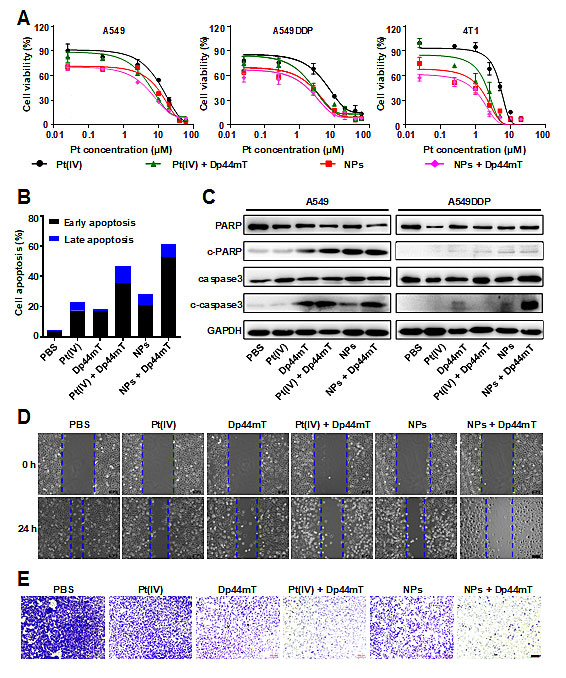
图2、纳米四价顺铂与去铁剂Dp44mT联合抗肿瘤细胞增殖与迁移的体外研究。(A)不用药物处理方式对癌细胞活性的影响,(B) 细胞流式术检测以上处理方式对细胞凋亡的影响,(C) Western Blot检测凋亡相关蛋白表达,(D)细胞划痕实验,(E) Transwell细胞迁移实验。
动物实验结果表明NPs能在小鼠肿瘤部位高效蓄积,从而提高药物的靶向利用率。NPs与Dp44mT联用能明显抑制小鼠乳腺癌细胞的生长,肿瘤重量降低了约5倍(跟对照组比)。通过激活细胞凋亡信号通路,二者联合诱导肿瘤细胞凋亡。此外,通过干扰细胞内的铁代谢,NPs与Dp44mT联用显著减少了癌细胞的肝转移与肺转移结节数(<3个),进而有效抑制乳腺癌的转移(图3)。
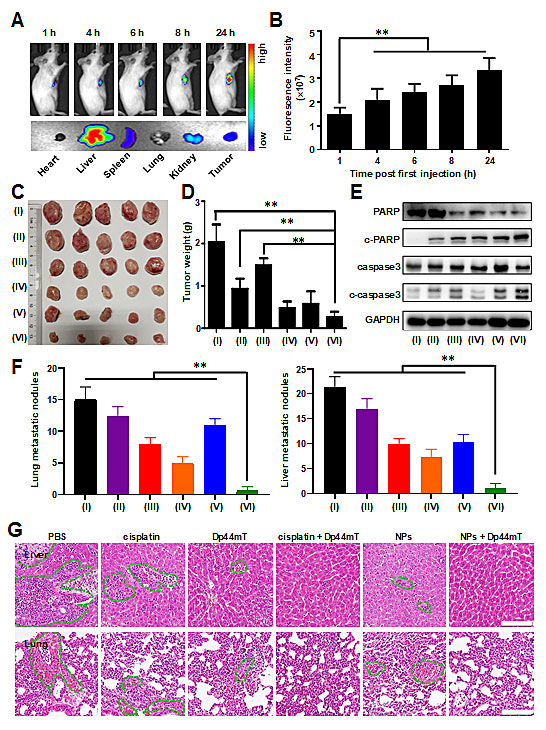
图3、纳米四价铂与去铁剂Dp44mT联合抑制小鼠乳腺癌增殖与转移。(A) NPs在小鼠肿瘤部位的蓄积、组织分布情况及统计学分析(B);(C)不同药物处理方式下小鼠肿瘤形态与肿瘤重量(D);(E) 细胞凋亡关键蛋白表达;(F)不同药物处理方式下小鼠肺部与肝脏结节数;(G) 小鼠肝与肺组织的H&E染色结果。其中:(I) PBS, (II) Pt(IV), (III) Dp44mT, (IV) Pt(IV) + Dp44mT, (V) NPs,(VI) NPs + Dp44mT。
以上研究成果近期发表在Nanoscale Horizons 期刊。本论文第一作者是中国科学院化学研究所与深圳大学联合培养博士后丁芳,上海瑞金医院宋海勤博士、深圳大学陈仕国教授与中国科学院化学研究所肖海华研究员为共同通讯作者。上述研究工作得到了国家自然科学基金(基金号:51873218)等项目的支持。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Enhancing Chemotherapy Efficacy of Platinum Prodrug Nanoparticles and Inhibiting Cancer Metastasis via Targeting Iron Homeostasis
Fang Ding, Lingpu zhang, Hao Chen, Haiqin Song, Shiguo Chen, Haihua Xiao
Nanoscale Horiz., 2020, DOI: 10.1039/D0NH00148A
肖海华研究员简介
中国科学院化学研究所肖海华研究员近10年来,立足生物医用高分子,聚焦金属铂类药,系统性地从事其高分子新剂型及其药物联合、基因联合体系的开发和临床转化研究。通过铂药单用、与其它抗癌药物和增敏剂联合、基因联合等方式,课题组围绕三大策略,即跨越生物屏障、解除细胞解毒机制、抑制DNA修复来构建纳米铂载药体系,降低铂类药物的毒副作用、增加疗效、抑制临床耐药的发生,目前已在Prog. Polym. Sci.、Nat. Commun.、Adv. Mater.、Adv. Funct. Mater.、J. Am. Chem. Soc.、Angew. Chem. Int. Ed.、Nano Lett.、ACS Nano、Mater. Today、 Coordin. Chem. Rev.、Biotechnol. Adv.、Biomaterials等期刊上发表近70篇论文,其中影响因子>10的20余篇,第一及通讯作者论文>30篇。申请了中国专利8项,获授权中国专利4项,美国专利2项;已荣获湖北省科技进步一等奖(2019年,排名:3/14)、吉林省自然科学二等奖(2015年,排名:3/5)、中美纳米医学与纳米生物技术学会未来科学家奖(2017年)。
https://www.x-mol.com/university/faculty/178031
 0
0