叔烷基胺广泛存在于药物分子/农用化学品、天然产物以及小分子生物探针中,其合成方法最早可以追溯到1885年R. Leuckart等人利用甲酸作为还原剂,将胺与羰基化合物进行还原胺化(Leuckart-Wallach反应,Ber., 1885, 18, 2341)。直到1972年,R.F. Borch等人用硼氢化钠、氰基硼氢化钠或三乙酰氧基硼氢化钠作为还原剂,通过“一锅法”将胺和羰基化合物制备成叔胺(Borch还原,J. Org. Chem., 1972, 37, 1673),也是目前制备叔胺的最常用方法,荣登药物化学常用反应第6位。
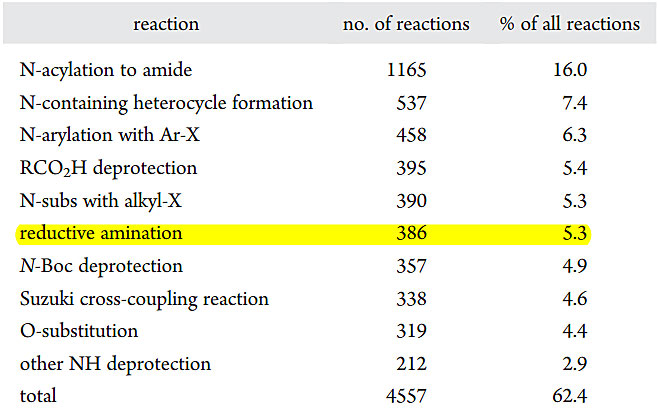
药物化学中十大常用反应:图片来源:J. Med. Chem., 2011, 54, 3451–3479
尽管叔烷基胺非常有用,但其合成方法长期以来仍依赖于羰基还原胺化,而该反应仍存在一定的局限性:仲烷基胺与二烷基酮的缩合反应通常很慢,可能需要使用活化试剂;二烷基酮的反应性较差且相对于醛来说并不易得(通常需要多步合成)。所以最简单的策略是用烷基亲核试剂进攻醛衍生的烷基亚胺离子,即羰基烷基胺化(carbonyl alkylative amination,CAA)。但郁闷的是,如果用普通的烷基金属亲核试剂(有机锌试剂或铈试剂)去进攻则几乎不能得到想要的叔烷基胺,而烷基格氏试剂和烷基锂试剂并不能兼容这种原位生成的亚胺离子,因此需要预先制备并分离不稳定的亚胺离子。此外,其强碱性会导致C=N双键邻位C-H键的竞争性去质子化,从而限制了其底物范围。Petasis反应中胺的底物范围虽然很广,但所使用的硼酸亲核试剂要求反应活性比较高,如C(sp)-、C(sp2)-和烯丙基硼酸或活化的亚胺(如下图b中R1和R2),很难使用烷基硼酸,因为亚胺C=N键的亲电性很弱。
为了解决以上困难,合成化学家设想引入电中性的烷基自由基。但目前只有一例报道:1991年,B. H. Kim等人将烷基汞盐在紫外光照射下生成相应的烷基自由基,随后对甲醛衍生的亚胺离子进行加成(J. Am. Chem. Soc., 1991, 113, 373)。显然,如果对烷基-亚胺离子加成则会产生铵自由基阳离子(aminium radical cation,ARC),后者通过氢原子转移(hydrogen atom transfer,HAT)便得到质子化的叔烷基胺(下图c)。不过这个策略并不容易,因为反应中产生的几种活性中间体会相互竞争导致副反应,比如为了与烷基自由基反应,需要保证体系中有高浓度的烷基亚胺离子,但后者又可能被HAT试剂还原。近日,来自英国剑桥大学的Matthew J. Gaunt教授(点击查看介绍)课题组利用可见光介导的自由基策略,将廉价易得的三种工业原料——醛、仲胺和烷基卤代物——转化为相应的复杂叔烷基胺。该反应操作简单、条件温和且无需金属催化,相关结果发表在Nature 上。
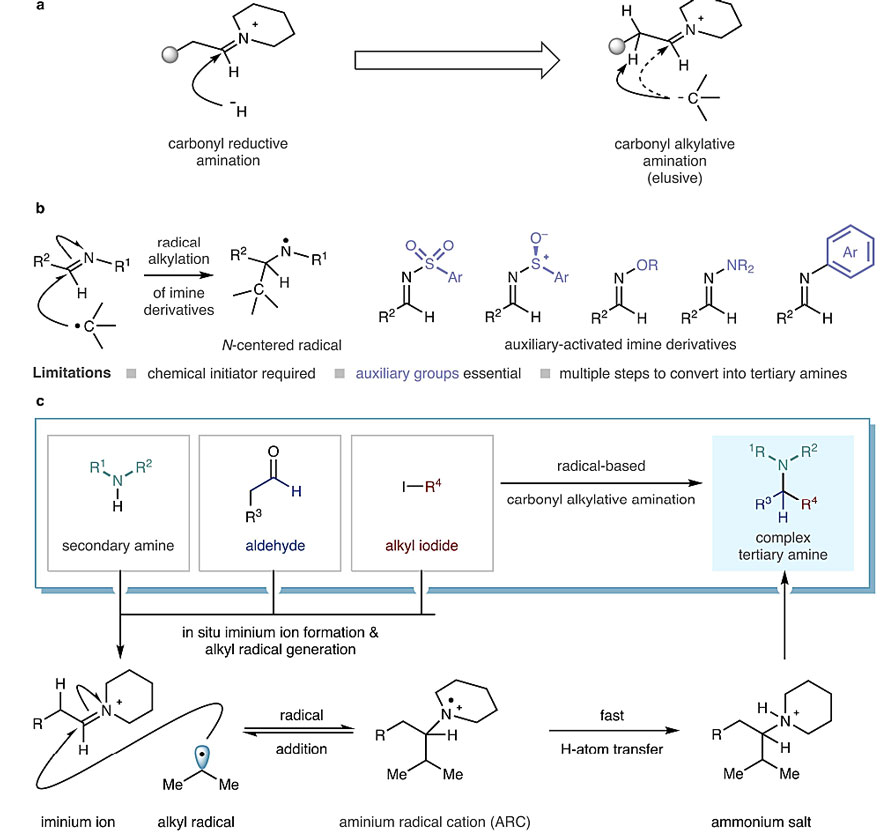
羰基烷基胺化策略的演化。图片来源:Nature
研究人员首先以N-甲基苄胺、氢化肉桂醛和2-碘丙烷为原料来筛选反应条件。在标准的自由基条件下(如Bu3Sn-H或(Me3Si)3Si-H+AIBN、70 ℃)仅能得到痕量的CAA产物4a。当在(Me3Si)3Si-H/AIBN体系中加入添加剂TBSOTf后,能显著地提高4a的收率,但也生成了1/3的还原胺化副产物。为了使操作更温和,研究人员引入了可见光并优化了反应条件,能够以较高的产率得到目标产物(entry 5-7),即使在无TBSOTf的条件下也能给出82%的收率(entry 6,适用于对酸敏感的底物)。尽管对这个现象的解释可能有几种,但C-I键的均裂是不太可能的,因为研究人员加装455 nm长通滤光片(过滤均裂所需的紫外和近紫外的光)仍然能以86%的收率得到4a(entry 7)。随后,研究人员系统地研究了CAA反应中各个底物、可能的中间体及复合物的吸光性质,发现没有一种成分或可能的中间体、复合物能够吸收大于455 nm的光,但烯胺(由1a和2a缩合而成)、2-碘丙烷(3a)和(Me3Si)3Si-H组成的三元混合物的UV-Vis吸收光谱显示出新的红移带(400-500 nm)。虽然目前还没有确凿的证据表明存在特殊的相互作用,但基于发现的事实,研究人员推断存在多组分相互作用并经可见光激发来引发自由基。
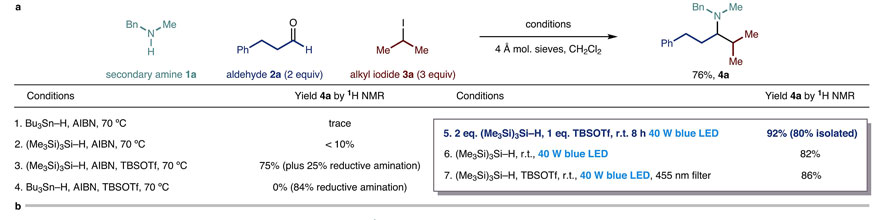
条件优化。图片来源:Nature
在最优条件下,研究人员对不同的胺进行了底物扩展(下图)。结果显示,饱和的环状仲烷基胺、杂环仲烷基胺以及链状的N,N-二烷基胺都能够兼容该反应(4a-4ae),以中等至较好的收率得到叔烷基胺。然而,当胺上的氮原子附近含有吸电子基团时,会观察到10%的还原胺化副产物(4s)。此外,对于N-烷基苯胺(4af-4ah)以及亲核性很柔的胺(如二芳基胺4ai、N-苯基羟胺4aj)都能实现“一锅煮”制备相应的叔烷基胺,表明该方法比辅基活化的自由基加成方法更实用。值得一提的是,一系列药物片段均可以耐受该反应(4ak-4aq),以较好的收率得到复杂的叔烷基胺。
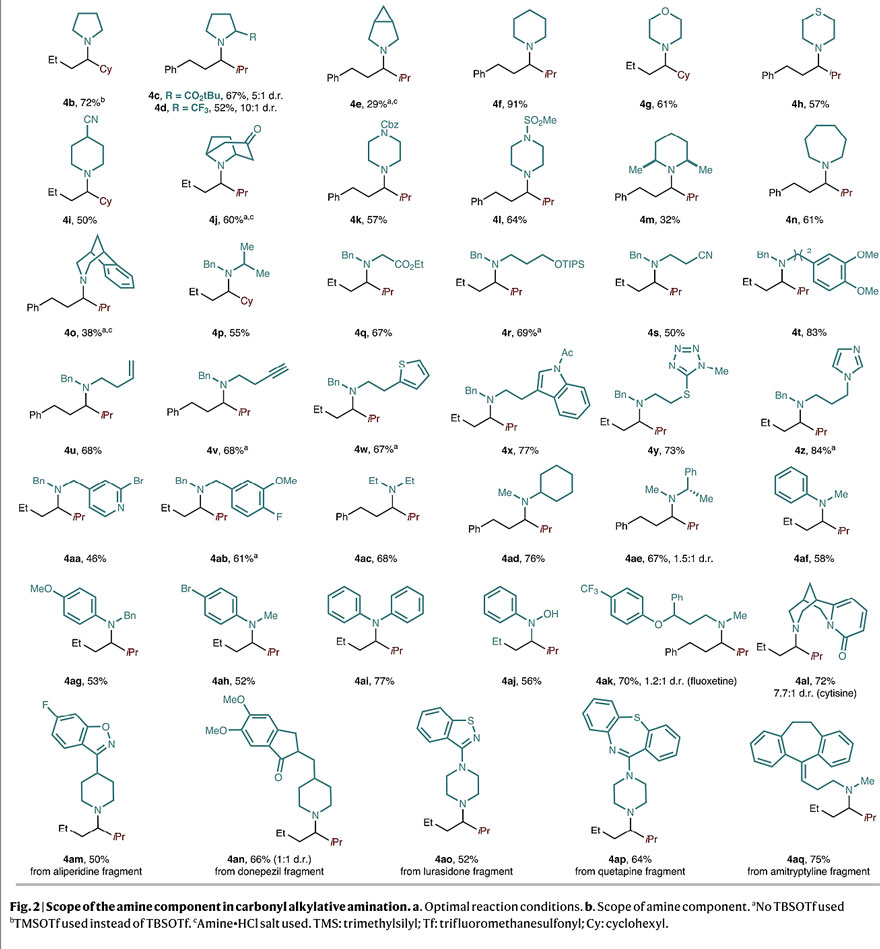
胺的底物扩展。图片来源:Nature
该反应中,醛和烷基卤代物的范围也是相当广泛,含有不同取代基的直链烷基醛(5a-5k)、带有支链的烷基醛(5l)、饱和的环烷基醛(5m-5n)以及杂环烷基醛(5o-5q)均能兼容该反应,以良好的收率得到叔烷基胺。值得一提的是,甲醛(5r)、取代的苯甲醛(5s-5v)以及杂芳基醛(5w-5x)都能以良好的收率实现这一转化,得到相应的叔烷基胺。随后,作者考察了烷基卤代物的底物范围,含有不同取代基的直链烷基卤代物(6a-6n)、环状的仲烷基卤代物(6o-6t)以及叔烷基碘代物(6u-6w)均能以良好的收率得到叔烷基胺。但是当烷基卤代物附近带有吸电子基团时,收率较低(6c),这可能是由于硅烷和烷基自由基之间的竞争性HAT以及亲电性烷基自由基与亚胺离子的加成速率较慢而引起的。此外,苄基溴和甲氧基甲基溴(其碘化物不稳定)也是合适的烷基化试剂,并以较好的收率得到目标产物(6l、6n)。值得一提的是,碘甲烷(6x)也能实现这一转化。
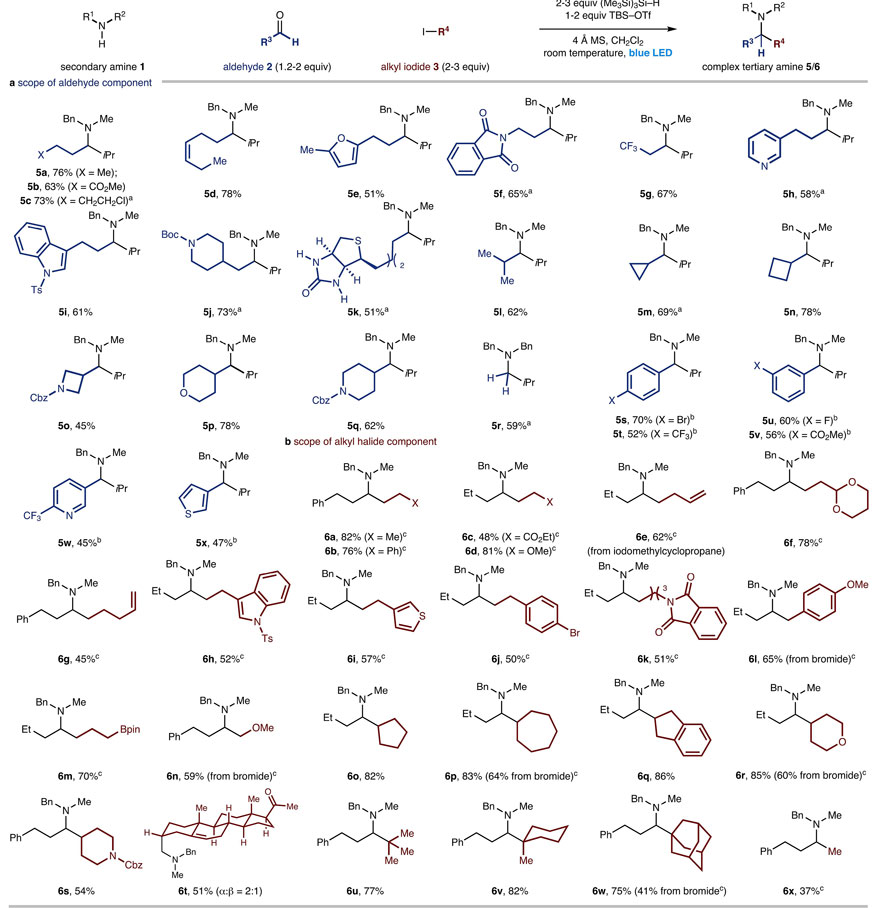
醛和烷基卤代物的底物扩展。图片来源:Nature
由于仲胺广泛存在于许多药物分子中,如治疗季节性过敏性鼻炎的desloratadine,而其叔胺衍生物最近也被证实能够显著提高药代属性并对组胺H1受体产生更长效的拮抗作用,因此研究人员通过CAA反应制备了一系列衍生物(8a-8h)。其实,研究人员先前就通过光氧化还原的方式将desloratadine与醛缩合而成的亚胺离子转化成α-胺基自由基,然后与活化的烯烃加成生成desloratadine的叔胺衍生物8i(Nature, 2018, 561, 522)。然而,相比之下,本文所提到的CAA反应是通过烷基自由基对亚胺离子进行加成的,具有更宽的底物范围,不需要预活化底物,便可将伯、仲甚至叔烷基卤代物与醛和仲胺“一锅法”转化为复杂的叔烷基胺(如9a-9g),而这三种底物都是简单易得的工业原料。
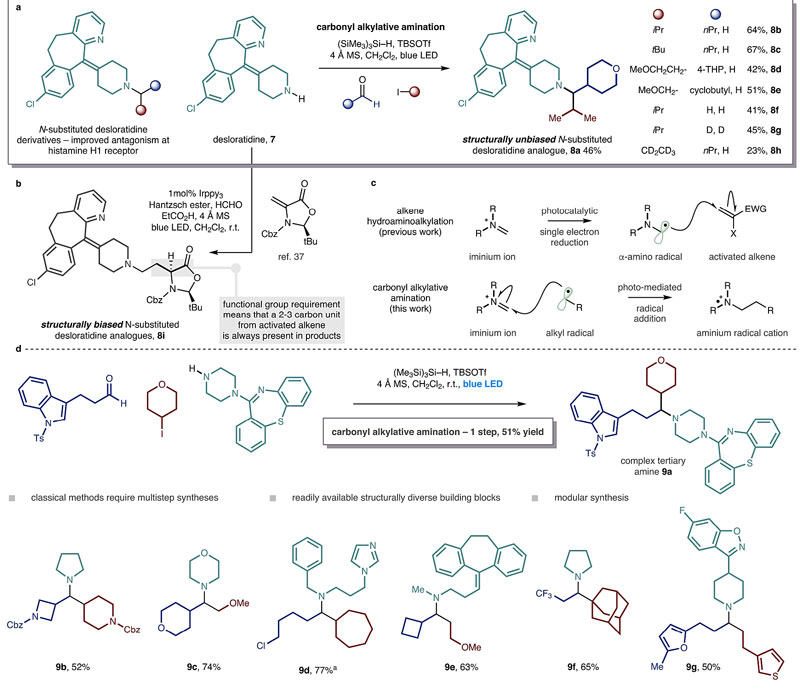
通过CAA一步制备复杂叔烷基胺衍生物。图片来源:Nature
简评
很多时候,有机化学家都被类比成“大厨”,但即使按照同样的菜谱,不同的“大厨”做出来的口味可能差别很大,甚至有的会很失败。笔者窃以为未来合成人员应该更像“流水线工人”,只要按照标准化规程操作各个有机“模块”就能得到质量可控的产品。但这就要求有机化学家开发出可以“模块化”的方法学。显然,Matthew J. Gaunt教授课题组发展的CAA反应便是其中之一。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

A general carbonyl alkylative amination for tertiary amine synthesis
Roopender Kumar, Nils J. Flodén, William G. Whitehurst, Matthew J. Gaunt
Nature, 2020, DOI: 10.1038/s41586-020-2213-0
导师介绍
Matthew J. Gaunt
https://www.x-mol.com/university/faculty/2561
(本文由峰千朵供稿)
 0
0