[3,3]-重排由于具有较高的化学、区域、立体选择性,在有机合成中具有广泛的应用。相比之下,[1,3]-重排的发展却并不成熟。一般情况下,热促[1,3]-重排需要苛刻的反应条件。后续研究发现,在过渡金属催化剂、亲核催化剂或Lewis酸催化剂存在下,[1,3]-重排可以经历两性离子中间体,在相对温和条件下发生。其中,Lewis酸催化是最为常见的催化方式。然而,手性Lewis酸催化的不对称[1,3]-重排反应却鲜有报道。主要存在以下三个挑战:(1)热促[1,3]-重排导致背景反应;(2)Lewis酸催化下,烯丙基乙烯基醚类底物存在[1,3]和[3,3]-重排两个竞争反应;(3)重排过程中的手性控制。铑盐可以促进三氮唑与苄醇衍生物的串联插入/重排反应,为α-氨基酮类化合物的高效合成提供了新途径。鉴于手性α-氨基酮是一类重要的天然产物和药物分子骨架,近日,冯小明院士(点击查看介绍)课题组在双金属接力催化三氮唑与烯丙醇类底物的串联插入/不对称[3,3]-重排(Angew. Chem. Int. Ed., 2018, 57, 16554)工作基础上,开展了三氮唑与苄醇类底物参与的不对称[1,3]-重排反应研究(图1)。
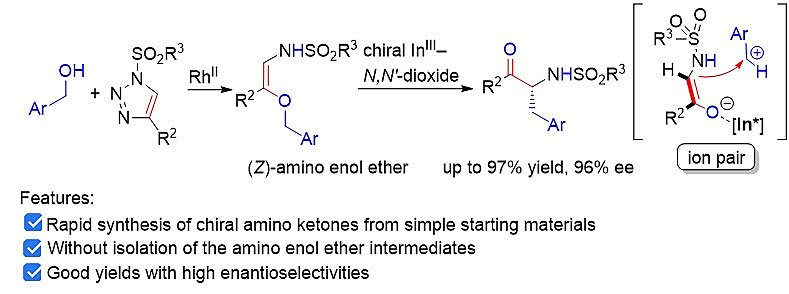
图1
在条件优化过程中作者发现铑催化剂不但参与了苄醇的O-H插入,还能促进第二步重排反应,给该串联反应的手性控制增加了难度。但通过控制实验发现,在较低的温度(90 ℃)下,热促以及铑盐促进的[1,3]-重排背景反应被抑制,而在此温度下手性Lewis酸催化剂却能有效催化后续的重排过程。
通过对反应条件的优化,最优条件确定为:1.25 mol% Rh2(esp)2作为非手性催化剂, 10 mol%L2-RaPr3/In(OTf)3配合物作为手性催化剂, 1,1,2-三氯乙烷作为溶剂,在90 ℃下反应24 h,以90%的收率,96% ee的对映选择性得到目标产物3ca(图2,entry 5)。
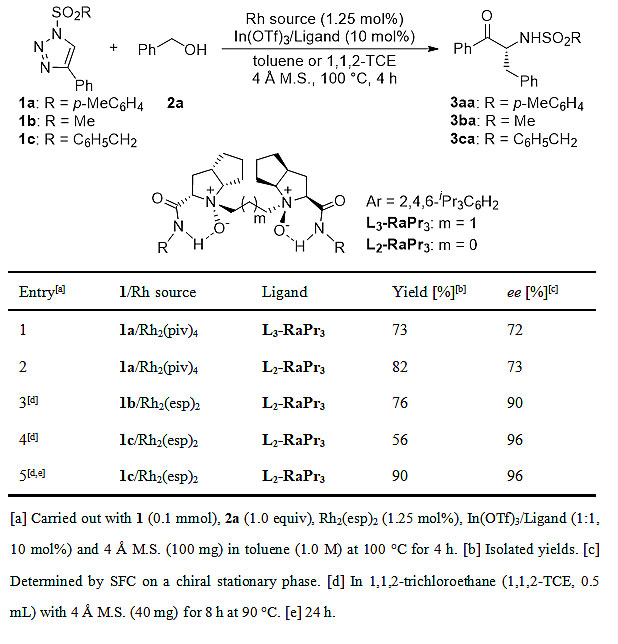
图2
结合最优条件,作者进行了底物扩展。如图3所示,含有不同官能团的苯甲醇在反应条件下都能生成对应的α-氨基酮且具有中等到良好的产率和优秀的对映选择性。值得一提的是,二苯甲醇也能参与到反应中,并能以不错的结果得到产物。尽管反应的结果有所降低,但噻吩-2-甲醇和1H-吲哚-3-甲醇对该反应条件也适用。有趣的是,呋喃-2-甲醇在没有手性Lewis酸催化剂存在的情况下,只会发生串联O-H插入/[3,3]-重排反应。然而,在双金属催化体系下,该底物能专一地发生O-H插入/[1,3]-重排并给出中等结果。此外,稠环底物1-萘甲醇也能顺利地进行串联反应。
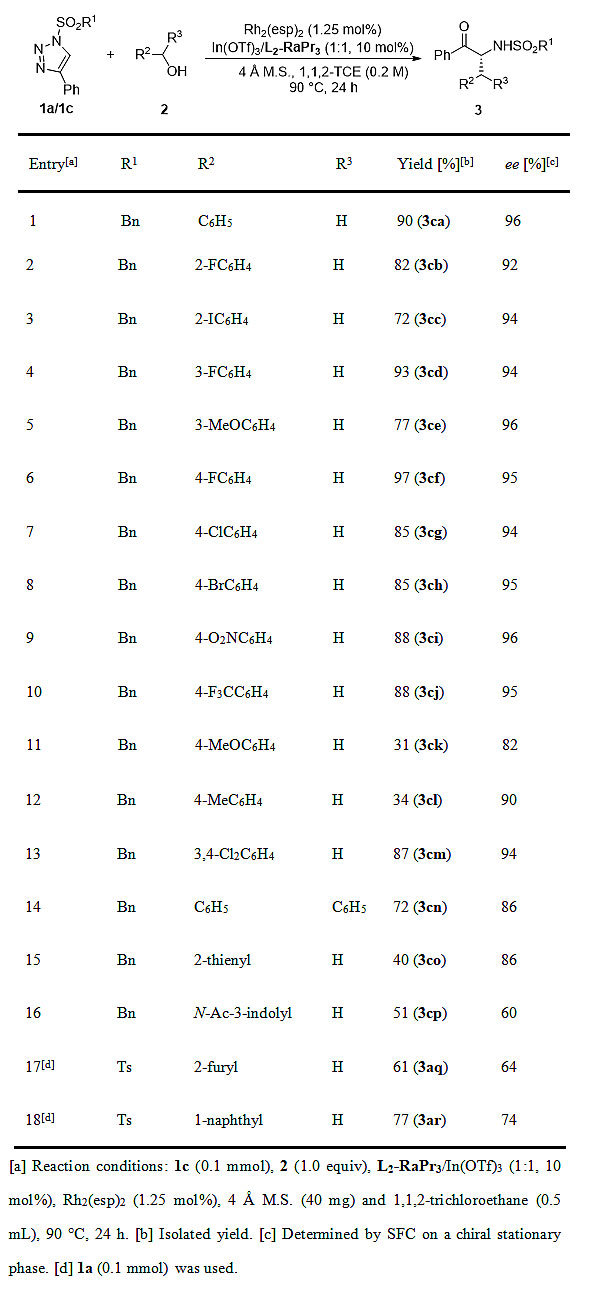
图3
在考察完醇类底物对反应的影响后,作者对具有代表性的三氮唑与苯甲醇的O-H插入/不对称[1,3]-重排反应进行了考察(图4)。不论是富电子还是缺电子芳香炔烃衍生的三氮唑均能顺利参与反应,并能以不错的结果拿到手性氨基酮。让人欣喜的是,该催化体系对脂肪族底物也同样有效。
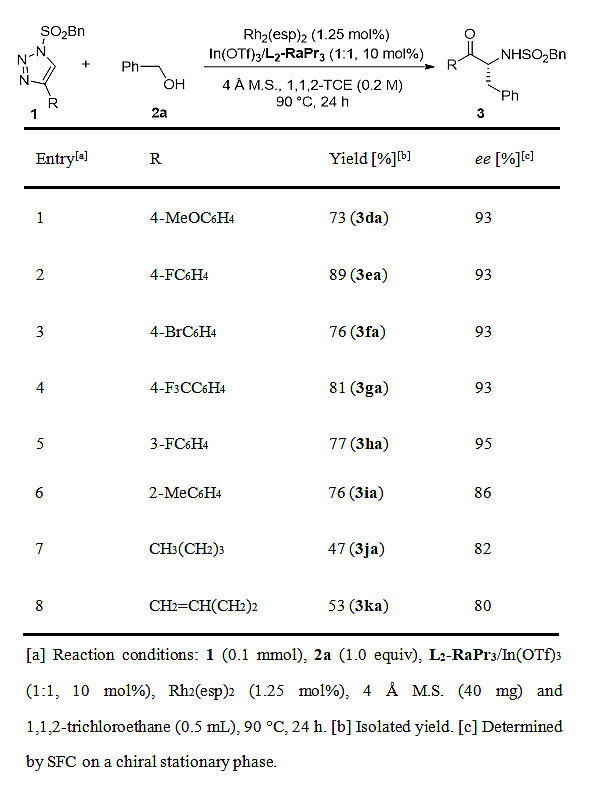
图4
为了探究反应的立体化学以及反应机理,作者进行了几个对照实验。如图5所示,当在120 ℃高温下,三氮唑与(S)-苯乙醇(2s)在Rh2(esp)2催化下可以立体专一性地得到插入/重排产物(2S,3S)-3as。其中C3位置的手性在重排过程中保持。这一结果显示该反应很可能经历了紧密离子对历程。随后,作者分别以氮氧L3-RaPr3和ent-L3-RaPr3为手性配体,对(S)-苯乙醇(2s)进行了催化反应。有趣的是,反应的非对映选择性和对映选择性都发生了明显变化。在L3-RaPr3存在下,以52:48的比例得到了两种非对映异构体的产物3as,对映选择性分别为82% ee和60% ee。相反地,如果使用ent-L3-RaPr3作催化剂,反应的非对映选择性有所提高(91:9 dr),且两种异构体C2位置新形成的手性中心均为(S)构型。由此,可以得出结论:1) 产物中C3位手性主要由手性醇控制;2) 新生成的手性中心则由手性醇和手性催化剂共同影响。为了进一步验证反应经历的是离子对历程,作者分离出含不同取代基的O-H插入中间体,并将其在手性路易斯酸催化条件下进行重排反应研究。通过原位红外监测中间体的消耗,得到不同取代基底物的线性自由能关系。作者发现苄醇对位取代基的Hammett常数(σ+)与反应速率(logVx/VH)呈负线性相关,反应常数ρ为-2.14,表明决速步中反应中心的正电荷密度升高,与离子对机理吻合。同时作者推测手性Lewis酸催化剂与烯醇负离子有着较强的相互作用,导致迁移物种可能从溶剂笼中释放出来,因此C3位手性无法完全保持。
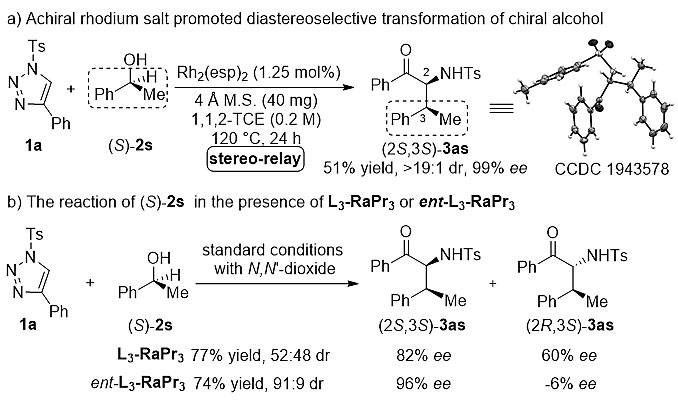
图5
总结
冯小明院士团队使用苯甲醇类底物和N-磺酰基三氮唑在铑/手性氮氧-金属配合物催化条件下发生串联插入/[1,3]-重排反应,以高收率高对映选择性得到α-氨基酮产物。同时本文还详细研究了催化反应中的手性控制问题。通过手性底物在相反构型催化剂作用下的结果以及控制实验、产物单晶结构,合理地阐释了反应的机理。该工作得到国家自然科学基金委的资金支持,相关结果发表在Angewandte Chemie上,文章第一作者为四川大学博士研究生陈煜双。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Tandem Insertion/[1,3]-Rearrangement: Highly Enantioselective Construction of α-Aminoketones
Yushuang Chen, Yun Liu, Zhaojing Li, Shunxi Dong, Xiaohua Liu, Xiaoming Feng
Angew. Chem. Int. Ed., 2020, DOI: 10.1002/anie.201914645
导师介绍
冯小明
https://www.x-mol.com/university/faculty/12766
课题组主页
http://chem.scu.edu.cn/chem-asl/
 0
0










