聚奎烷(Polyquinanes)是一类含有稠合五元环的重要碳环骨架(图1),广泛存在于各种天然产物中,如萜类和甾体类化合物。1997年,Weavers等人从新西兰罗汉松(Podocarpus totara var waihoensis)中分离出了(+)-waihoensene(1, Tetrahedron Lett., 1997, 38, 4297-4300)。从结构上讲,它含有一个高度拥挤且顺式稠合的四环母核以及六个连续的立体中心,其中四个为连续的全碳季碳原子(C3a、C5a、C9a、C11a)。因此,想要实现1的全合成颇具挑战。2017年,Lee等人首次以18步实现了(±)-waihoensene的全合成,其特征是串联的[2+3]环加成反应以构建具有两个连续季碳立体中心的BCD三环(图1a,Angew. Chem. Int. Ed., 2017, 56, 8254-8257)。
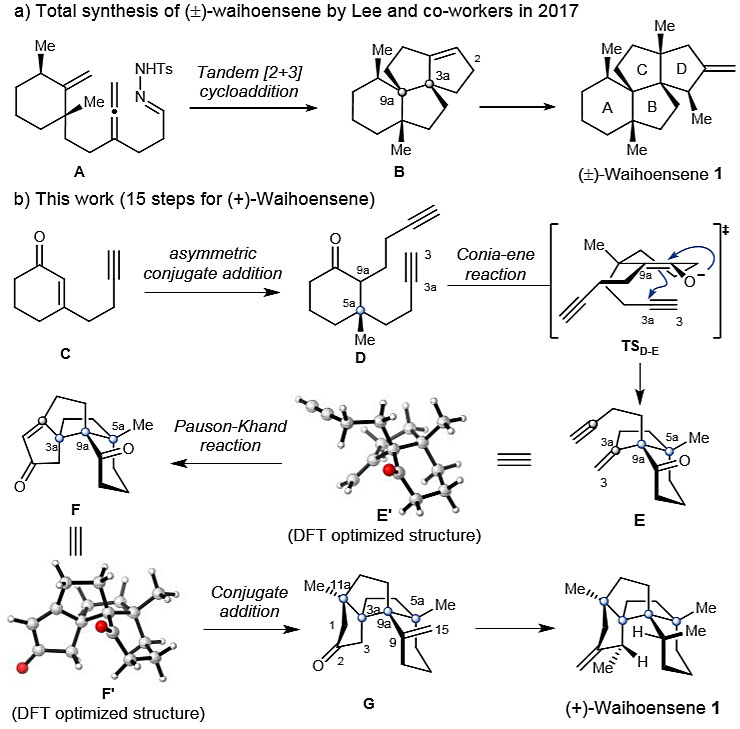
图1. (+)-waihoensene (1)的全合成。图片来源:J. Am. Chem. Soc.
近日,北京大学杨震教授和黄俊副研究员团队首次实现了(+)-waihoensene(1)的不对称全合成,总共15步,总产率为3.8%。该合成路线主要有以下特征:1)Cu催化的不对称1,4-共轭加成;2)非对映选择性的Conia-ene反应;3)非对映选择性的分子内Pauson-Khand反应;4)Ni催化的非对映选择性1,4-共轭加成;5)自由基引发的分子内氢原子转移(HAT)。相关成果发表在J. Am. Chem. Soc. 上。
如图1b所示,具体合成路线如下:通过Cu-催化的烯酮C的不对称共轭加成,在二炔D的C5a处建立首个季碳立体中心。对过渡态TSD-E和烯炔E的3D结构充分研究后,发现可通过二炔D的Conia-ene型反应和烯炔E的分子内Pauson-Khand反应,非对映选择性地构建角三奎烷F核心中的两个季碳立体中心——C9a和C3a。根据Lee所报道的waihoensene(1)的全合成,中间体G中C11a处的季碳立体中心可通过铜酸盐介导的共轭加成反应来构建。因此,(+)-waihoensene(1)的不对称全合成可以通过G中C9-C15双键的非对映选择性还原来完成。
首先,作者从对映选择性合成二炔7开始,通过六步方法以消旋形式制备7。随后,作者采用Alexakis的策略不对称合成7(图2,Org. Lett., 2013, 15, 2152-2155)。烯酮2与格氏试剂反应得到3,然后使用Alexadis的方法来构建烯酮4中的C5a立体中心,总产率为61%。烯酮4经Sakurai反应烯丙基化、臭氧分解,以两步58%的总产率得到醛6,随后与Ohira-Bestmann试剂反应并原位脱去TMS,以72%的产率得到手性二炔7。
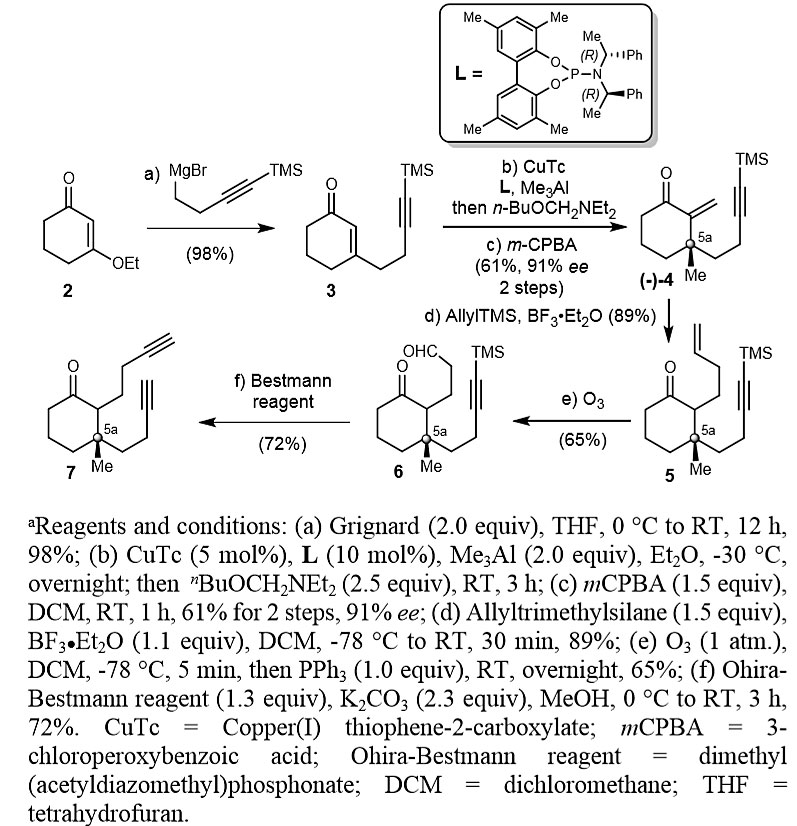
图2. 二炔7的不对称合成。图片来源:J. Am. Chem. Soc.
随后,作者将注意力转向了带有四个连续季碳立体中心的二酮10的合成(图3)。在催化量tBuOK的作用下,7通过Conia-ene型环化以83%的产率非对映选择性地制备8。而具有Thorpe-Ingold辅助作用的烯炔8很可能是设计的Pauson-Khand(PK)反应(用于制备6-5-5-5四环化合物9)的良好底物。于是,作者尝试了几种经典的PK反应条件,如在三甲胺N-氧化物(TMANO)、甲基吗啉N-氧化物(NMO)和四甲基硫脲(TMTU)存在下Co2(CO)8介导的PK反应,以及其他过渡金属如PdCl2/TMTU和[Rh(CO)2Cl]2催化的PK反应。但是,大多数情况下,仅以22–38%的分离产率得到所需产物9。值得注意的是,当反应在N2O存在下,在二氯乙烷中于80 °C进行20 h时,可以93%的ee 值和59%的产率获得9,随后通过Ni-催化的甲基化反应以81%的产率得到单一的非对映异构体——二酮10。
接下来的挑战在于C-3和C-9位的区域选择性和非对映选择性甲基化。由于其较小的空间位阻,作者设想可以将10中的C2位酮羰基用其相应的缩酮形式选择性保护,然后进行Wittig反应。实际上,在催化量TsOH的作用下,10与2-乙基-2甲基-1,3-二氧戊环反应,以91%的产率得到11,然后进行Wittig反应、脱缩酮化生成酮12(两步总产率69%)。
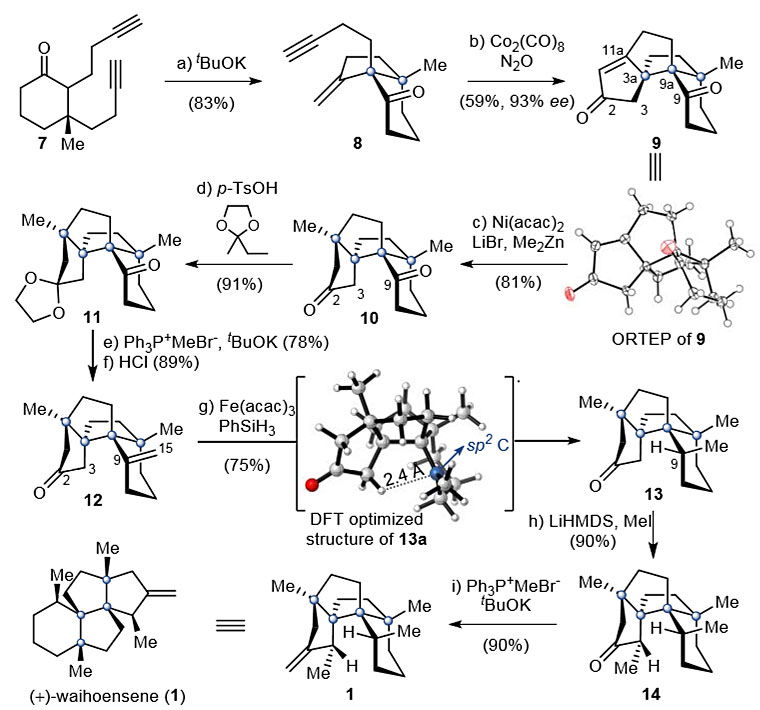

图3. (+)-waihoensene (1) 的全合成。图片来源:J. Am. Chem. Soc.
但是,12中环外烯烃的非对映选择性还原非常困难,常用的过渡金属催化剂(如Pd/C、PtO2、Rh(PPh)3Cl)所提供的产物与13中C9位的立体化学完全相反,因为催化剂从12中位阻较小的凸面接近双键,从而导致产物的立体化学完全相反。鉴于氢原子转移(HAT)反应已成为复杂天然产物全合成的有力方法,作者推测13a中新形成的C9自由基是源于12的自由基介导的还原反应,由于C3和C9之间的距离较近(2.4 Å)以及邻近C2羰基,因此可以通过C3分子内的HAT攫取质子,从而实现C9–C15双键的非对映选择性还原。于是,作者首先应用Shenvi开发的方法(J. Am. Chem. Soc., 2014, 136, 1300-1303),即在PhSiH3和TBHP存在下用催化剂Mn(dpm)3处理12,以67%的产率获得了主要异构体13,同时伴有10%的非对映异构体。然后,作者尝试了Baran发展的条件(J. Am. Chem. Soc., 2014, 136, 1304-1307; Nature, 2014, 516, 343-348; Science, 2015, 348, 886-891),即在PhSiH3、催化剂Fe(acac)3的作用下发生反应,以75%的收率获得单一的非对映异构体13。随后作者采用Lee的方案来安装最后的甲基。用LiHMDS处理酮13,将所得的烯醇化物与碘甲烷反应,以90%的收率得到14。接着将14和膦叶立德在回流的甲苯中反应,以100 mg的规模和90%的产率获得产物(+)-waihoensene(1),其1H和13C NMR谱以及旋光度与文献中报道的数据完全吻合,首次确定了(+)-waihoensene(1)的绝对立体化学。
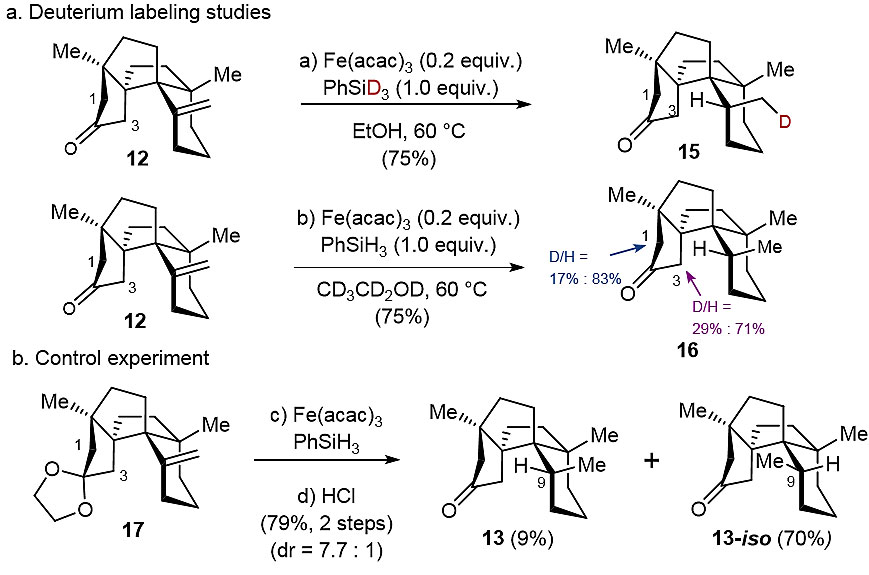
图4. 氘代实验和控制实验。图片来源:J. Am. Chem. Soc.
为了进一步证明HAT在本文全合成中的关键作用,作者进行了氘代实验和对照实验(图4)。当12在催化量的Fe(acac)3、PhSiD3(1.0当量)以及EtOH中于60 °C下反应1 h后,以75%的收率得到单一的非对映异构体——氘代酮15。当在氘代乙醇(CD3CD2OD)中进行相同的反应时,以75%的产率获得了产物16,并且在C3位(29%D)和C1位(17%D)均发现了氘原子(总共D/H ≈ 1/3)。这表明在这种基于自由基的还原中,从C1和C3碳原子中攫取质子而产生的[1,4]-和[1,5] -HAT过程都有可能发生。此外,与酮12相比,缩酮17的C1和C3位质子较不活泼,当进行相同的反应时,以70%的产率得到C9处立体化学完全相反的13-iso,而13的产率仅为9%。
接下来,作者尝试解释形成15和16的非对映选择性。对于椅式构型13a,通过5元过渡态TS1(最有利的过渡态ΔΔG‡= 0)进行的1,4-HAT和通过6元过渡态TS4(ΔΔG‡= 1.2 kcal/mol)进行的1,5-HAT,两者之间活化能的差值很小,从而解释了氘代实验的结果。对于船式构象13b,1,4-HAT过渡态TS2(ΔΔG‡= 17.5 kcal/mol)和1,5-HAT过渡态TS3(ΔΔG‡= 24.1kcal/mol)的能垒均远高于通过TS1和TS4的能垒,这表明TS2和TS3不利于由12形成13,同时也表明了HAT过程通过椅式过渡状态13a进行。此外,作者也解释了13-iso的形成,结果表明缩酮17可能同时进行分子内HAT反应和分子间攫氢反应,从而生成13和13-iso。

图5. DFT计算。图片来源:J. Am. Chem. Soc.
总结
北京大学杨震教授课题组首次以15步、总产率3.8%实现了(+)-waihoensene (1)的不对称全合成。其关键步骤在于Fe(acac)3/PhSiH3介导的分子内HAT反应,该反应可通过[1,4]-和[1,5]-HAT过程实现12中C9–C15环外双键的非对映选择性还原。该策略为其他复杂天然产物的全合成提供了一条有效的途径。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Asymmetric Total Synthesis of (+)-Waihoensene
Yongzheng Qu, Zheyuan Wang, Zhongchao Zhang, Wendou Zhang, Jun Huang, Zhen Yang
J. Am. Chem. Soc., 2020, 142, 6511-6515, DOI: 10.1021/jacs.0c02143
导师介绍
杨震
https://www.x-mol.com/university/faculty/8607
 0
0









