英文原题:Dual-Functional Plasmonic Photothermal Biosensors for Highly Accurate Severe Acute Respiratory Syndrome Coronavirus 2 Detection
通讯作者:Jing Wang,ETH Zurich/Empa
作者:Guangyu Qiu, Zhibo Gai, Yile Tao, Jean Schmitt, Gerd A. Kullak-Ublick, Jing Wang*
新型冠状病毒肺炎(COVID-19)自爆发以来在全球持续蔓延,已经对超过200个国家的公共卫生安全构成了严重威胁。引起这种严重急性呼吸系统综合症的新型病毒被称为SARS-CoV-2,是一种单链RNA病毒。目前,医院和诊断机构广泛使用的逆转录聚合酶链反应(RT-PCR)是判断COVID-19感染和检测SARS-CoV-2病毒核酸序列的参考方法,也被认为是确诊的“金标准”。但是,PCR技术也会报告诸多假阳性或假阴性的错误结果,因此在临床诊断中,单次阴性PCR结果不能完全排除COVID-19感染,尤其当分析检测物为上呼吸道样本。
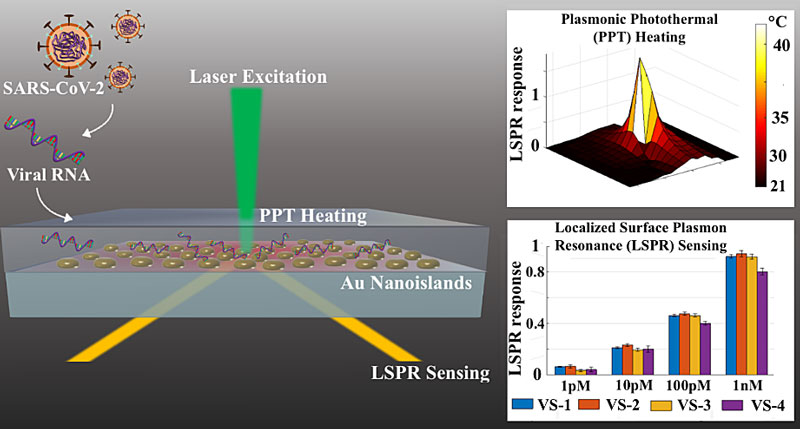
图1. 双功能光热增强等离子共振生物光学传感器示意图
基于以上分析,苏黎世联邦理工学院Jing Wang教授课题组设计了一种结合局部表面等离子体共振(LSPR)生物传感和等离激元光热(PPT)效应的双功能等离子体生物传感器,并将其应用于SARS-CoV-2病毒核酸检测。这种双功能等离子体生物传感概念将PPT光热效应和LSPR传感整合到一经济高效的二维金纳米(AuNI)芯片之上,并在此AuNI芯片之上同时实现局部PPT加热和原位核酸杂交检测。由于光源激发入射角度不同,使得两种等离子体共振效应的共振波长彼此分开。例如,优化后的AuNI芯片可对法相入射的532nm激光产生共振吸收,并转化产生局部PPT光热效应;此AuNI芯片亦可对以全反射(ATR)角度入射的580nm检测光束产生相位调制,并用于LSPR生物传感。这种双波长激发的方法不仅可以提高生物检测的稳定性和灵敏度,并且可以用于原位表征PPT光热产生的局部温度变化。在实验中,作者首先校准了不同环境温度下的LSPR相响应,并通过测量在不同功率的激光照射下AuNIs附近的热致折射率变化来表征PPT效应引起的原位温度变化。其中,通过对激光光斑的原位扫描,可以发现位于光斑中心位置的二维AuNI芯片受PPT光热激发,其局部温度显著升高至41 °C。
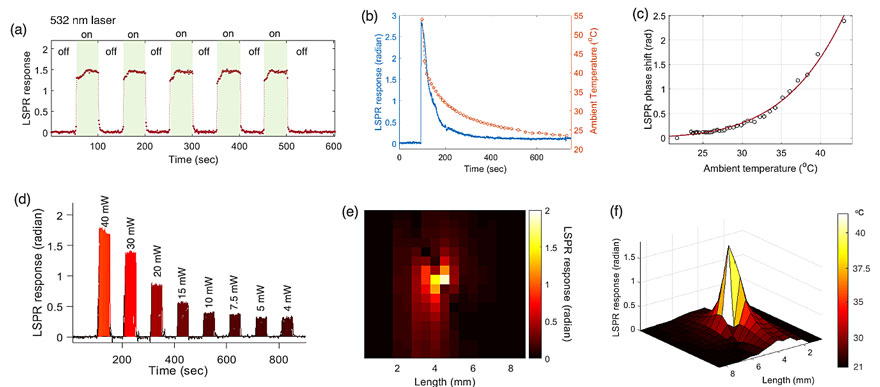
图2. AuNI上局部PPT加热的原位表征。(a)周期性激光激发和PPT引起的等离子体相响应。(b)温度变化和实时LSPR响应。(c)温度与LSPR相位响应之间的校准关系。(d)在不同激光功率下,由激光诱导的PPT效应引起的实时LSPR响应。(e)在AuNI上PPT热源周围的LSPR相位响应。(f)绘制PPT热源周围的温度分布图。
在对新型冠状病毒SARS-CoV-2的特定核酸序列检测中,作者选用了多个目前正在临床使用的寡核苷酸序列,例如RdRp、ORF1ab和E序列。通过在双功能生物传感器上修饰与之配对的互补碱基序列,来探究等离子体光热的增强效果。首先,在局部PPT加热的作用下,互补碱基对的杂交动力学得到提升。因此在单位时间内目标病毒序列可以产生更高的响应,以利于快速灵敏的检测。更为重要的是,PPT加热能够通过升高AuNIs附近的局部温度来抑制不匹配序列的杂散结合。SARS-CoV(2003年非典病毒)和SARS-CoV-2病毒是相似的β冠状病毒,它们的遗传序列相似性很高。在选择的RdRp基因片段中,RdRp-COVID和RdRp-SARS之间只有三个固定的核苷酸碱基不同。通过在原位PPT加热下进行光学检测发现,由于目标检测序列与修饰的探针不能完全匹配,使得两者杂交的标准自由能变弱,从而出现热致解离现象。而完全匹配的目标检测序列在此升温过程中具有很好的稳定性。因此,PPT原位光热场可以区分在检测物中的相似但不完全匹配的序列。
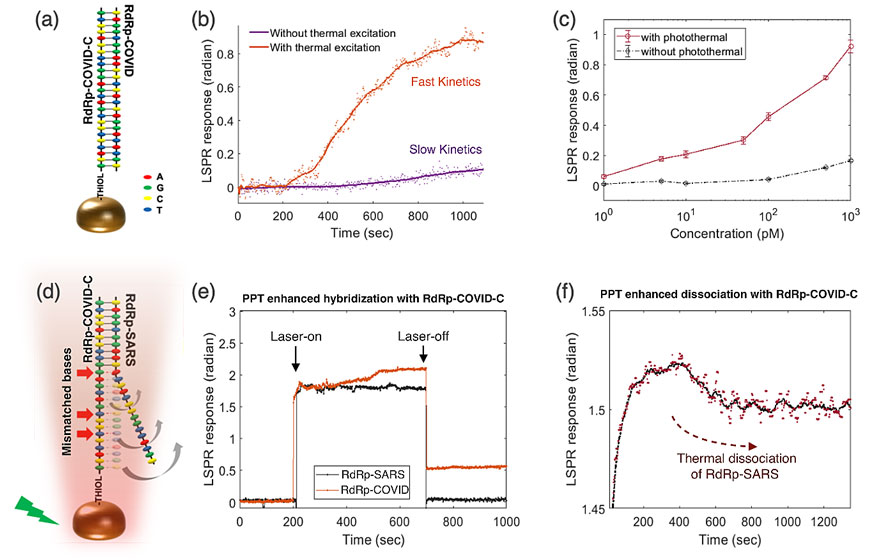
图3. LSPR生物传感中的PPT增强效果。(a)两条互补链杂交的检测示意图。(b)RdRp-COVID及其互补DNA序列(RdRp-COVID-C)在有无热等离子体增强时的杂交响应。(c)在不同浓度的RdRp-COVID序列检测中PPT增强。(d)两个不完全匹配的非特异性序列的杂交抑制示意图。红色箭头表示RdRp-SARS和探针RdRp-COVID-C的错配碱基。(e)用PPT加热区分两个相似的序列。激光在200 s处施加,在700 s处关闭。(f)RdRp-SARS序列与固定的RdRp-COVID-C序列解离。红色点为原始相位响应,黑色曲线为平滑后的响应趋势。
Jing Wang教授课题组设计的双功能LSPR生物传感器对选定的SARS-CoV-2序列具有高灵敏度,检测限低至0.22 pM。通过计算得出的预估临床检测能力可以达到2.26 × 104 个病毒RNA。在最近刊发的关于新型冠状病毒患者的临床标本研究中表明,病人在发病后的平均病毒载量普遍高于1×106拷贝每毫升。这进一步表明此双功能LSPR系统具有直接分析呼吸道样本中SARS-CoV-2序列的潜力。
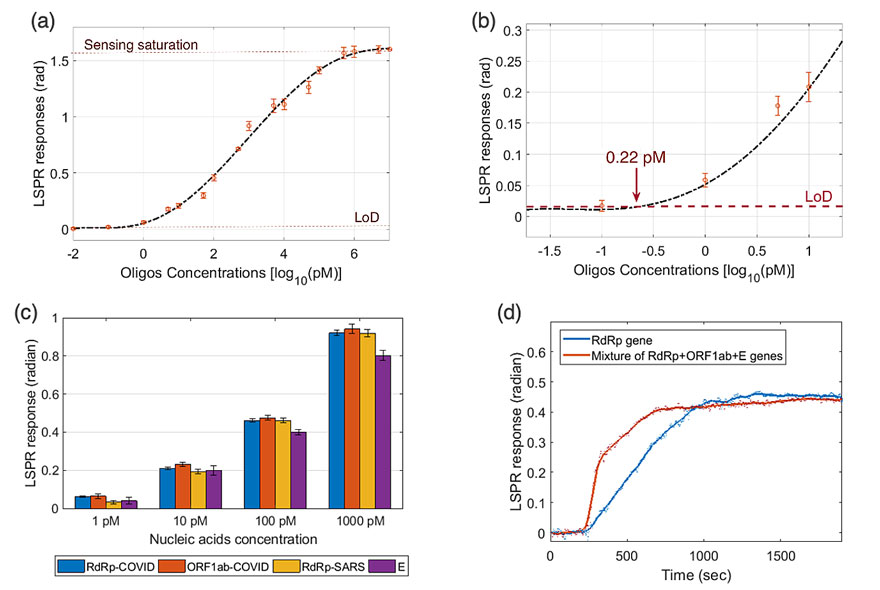
图4. 双功能LSPR生物传感器在病毒核酸检测上的性能评估。(a)LSPR相位响应与RdRp-COVID寡核苷酸浓度的回归分析拟合。(b)用于评价核酸检测检出限的低浓度范围放大视图。(c)使用双功能LSPR生物传感器测量的各种不同病毒寡核苷酸的浓度响应。(d)单个分析物和多个序列的混合物的检测比较。
苏黎世联邦理工学院Jing Wang教授课题组开发的双功能等离子体系统已成功展示出用于新型冠状病毒SARS-CoV-2检测的高度灵敏,快速且可靠的诊断潜力。这种双重功能的等离子体生物传感概念将PPT效应和LSPR传感转导整合到经济高效的AuNI芯片之上。通过使用两个不同的入射角,可以在两个不同的波长激发PPT和LSPR效应,从而显著增强了感测稳定性、灵敏度和可靠性。更重要的是,AuNI芯片上的原位PPT光热增强显著改善了杂交动力学和核酸检测的特异性。在未来病毒爆发的潜在威胁下,此新型双功能LSPR生物传感器可以提供可靠且易于实现的诊断平台,以提高临床测试的诊断准确性,并减轻基于PCR的临床测试压力。
这一成果近期发表在ACS Nano 上,ETH Zurich/Empa博士后研究员邱广宇为文章的第一作者,Jing Wang教授为通讯作者。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Dual-Functional Plasmonic Photothermal Biosensors for Highly Accurate Severe Acute Respiratory Syndrome Coronavirus 2 Detection
Guangyu Qiu, Zhibo Gai, Yile Tao, Jean Schmitt, Gerd A. Kullak-Ublick, Jing Wang*
ACS Nano, 2020, DOI: 10.1021/acsnano.0c02439
Publication Date: April 13, 2020
Copyright © 2020 American Chemical Society
(本稿件来自ACS Publications)
 0
0









