核酸和蛋白质是生命体基础结构与功能单位的最重要成分,充分了解核酸和蛋白质的精细结构与功能之间的联系并且精准操控它们的精确组装,将有力促进新型生物纳米机器的人工设计和制造。针对这一挑战,中科院苏州纳米所王强斌研究员课题组与美国Emory大学柯勇刚教授合作,探索利用DNA纳米技术结合病毒纳米颗粒的增殖装配机制来制造复杂可控的核酸-蛋白质新型组装系统。病毒是自然界进化发展的一种典型的自组体。它的装配过程具有很高的特异性和效率,能够在较短时间内利用弱键协同作用组装生产出大量的病毒颗粒。目前已经知道,病毒基因组与衣壳蛋白的互作规律对整个病毒装配过程起到非常重要的作用。如果能够在纳米尺度下对病毒基因组相关序列的状态进行精确操纵,则有可能实现人为调控病毒蛋白的各个复合组装步骤。

图1. DNA-TMV复合结构的原位、静态可控组装。
首先以烟草花叶病毒(tobacco mosaic virus, TMV)作为模式系统,探索了不同条件下TMV基因组RNA与衣壳蛋白的互作规律及其对病毒颗粒的原位装配调控(图1)。TMV基因组特定的组装起始序列可有效引导核酸与病毒衣壳蛋白的特异性结合并引发体外重构组装,并且病毒蛋白管的组装长度是由RNA长度决定的,从而为蛋白域的精确调控提供了可能。研究人员构建了一维到三维DNA origami模板作为支架结合不同长度的TMV RNA重组序列,引导后续的原位组装过程。通过支架表面结合位点和序列的设计,不仅能实现TMV病毒蛋白管在DNA支架特定位置按一定组装程序进行定向装配生长,还完成蛋白管原位组装长度的有效调控。这项工作发表在《美国化学会志》杂志上(J. Am. Chem. Soc., 2018, 140, 26, 8074)。
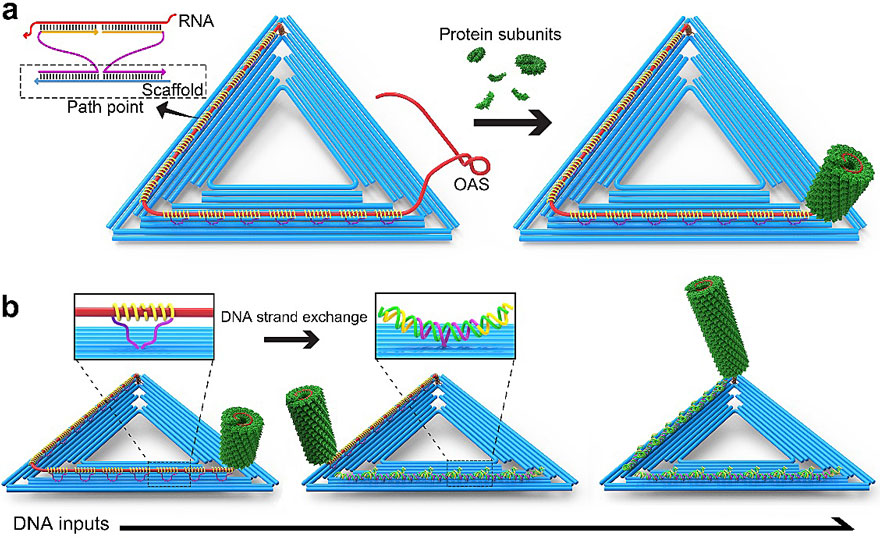
图2. DNA-TMV复合结构的可编程、动态可控组装。
在此基础上,研究人员进一步对病毒基因组相关RNA序列的活性状态进行了巧妙设计,实现病毒蛋白组装步骤的动态调控(图2)。首先,通过DNA origami上伸出的互补交联序列的设计,实现RNA的有序排布;然后,RNA长链上伸出的病毒组装起始引导序列(OAS)结合TMV病毒衣壳蛋白亚基,启动持续组装直至到达DNA origami支架表面而暂停;最后,通过控制DNA origami支架表面固定链的有序打开,逐步释放预定长度的RNA序列,实现蛋白组装程序的精确控制,并且操纵组装体按预定路线进行精确移动。利用DNA支架提供的锚定平台综合病毒蛋白装配机制,他们设计构建的核酸-蛋白质动态组装系统在以下几方面具有重要意义。(1)首次提出利用DNA origami实现RNA长链可控编程,成功调控病毒蛋白装配过程。(2)有望实现不同病毒蛋白亚基突变体参与动态组装过程,制备具有多种功能化区域的病毒样组装体。(3)与已有的核酸-蛋白质多层级组装体构建方法相比,无需要对蛋白基元进行特殊处理,结合分子探针技术,有望用于细胞内病毒组装体系的实时装配检测。该成果近期发表在《美国化学会志》杂志上并入选JACS 亮点论文 [1]。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Programming Dynamic Assembly of Viral Proteins with DNA Origami
Kun Zhou, Yihao Zhou, Victor Pan, Qiangbin Wang, Yonggang Ke
J. Am. Chem. Soc., 2020, 142, 5929-5932, DOI: 10.1021/jacs.9b13773
1. Spotlights on Recent JACS Publications. J. Am. Chem. Soc., 2020, 142, 6835-6836, DOI: 10.1021/jacs.0c03750
https://pubs.acs.org/doi/abs/10.1021/jacs.0c03750
 0
0










