天然产物一直以来都是新药研究和开发的源泉,据报道,80%的药物分子来源于天然产物及其衍生物。生物碱是存在于自然界中的一类含氮碱性有机化合物,为天然产物有效成分的主要类别之一,已知生物碱基本结构约60种,已知化合物数量超过10000个。因生物碱类化合物结构多样、活性广泛,高活性、代表性化合物数量众多,相关研究一直受到化学家及生物学家的高度关注。
Suffrutines A(E, E-双烯构型)及其双键互变异构体suffrutines B(Z, E-双烯构型),为叶文才教授课题组于2014年首次从叶底珠(Flueggea suffruticosa)根部分离得到的具有吲哚里西啶骨架的生物碱类化合物 [1]。由于其结构新颖,suffrutines A及B被英国皇家化学会旗下著名期刊杂志Natural Products Report 评选为当年的热点化合物(hot compounds) [2]。此后,关于suffrutines A和suffrutines B的合成和活性研究报道较少。
近日,中山大学陈新滋院士(点击查看介绍)团队邹永教授(点击查看介绍)课题组报道了suffrutines A和suffrutines B的全合成,在此基础上进行结构改造获得含氮衍生物1'-aza-suffrutines A和1'-aza-suffrutines B,并获得了上述4个目标化合物的X-射线单晶衍射数据。其中,天然产物suffrutines B及两个含氮衍生物的单晶结构均为首次报道。该工作还探究了在25℃、光照条件及溶液状态下suffrutines四个几何异构体的相互转换及稳定性的关系,并经DFT理论计算进一步验证。此外,该课题组还对suffrutines A、B及其含氮衍生物进行了体外抗肿瘤活性评价。
作者从商业可得原料吡咯(3)出发(图1),对吡咯环上-NH进行保护,经傅克酰基化反应和水解反应得到3-乙酰基吡咯(7)。7与1,4-二溴丁烷发生发生取代反应,生成中间体9,9在Pd(PPh3)4、Cs2CO3及光照条件下经分子内自由基取代环化反应顺利构建含吲哚里西丁骨架片段10。片段10与氰甲基磷酸二乙酯(11)发生Wittig-Honer反应,再经DIBAL-H还原为含醛基的化合物13,化合物13与邻羟基苯乙酸(14)经Perkin反应生成终产物suffrutines A和suffrutines B。在该合成路线基础上,用2-吲哚酮(15)替代邻羟基苯乙酸为底物与中间体13生成氮杂衍生物1'-aza-suffrutines A和1'-aza-suffrutines B。4个终产物的化学结构均经1HNMR、13CNMR、2D-NMR、HRMS及X-射线单晶衍射得到确证(图2)。

图1. 合成路线
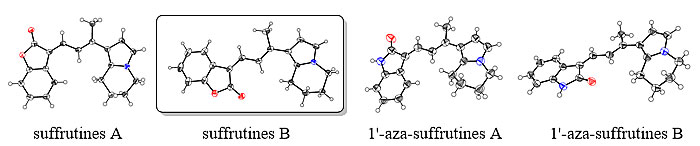
图2. 目标化合物X-射线单晶衍射图
邹永教授课题组发现suffrutines四个异构体(1a、1b、1c和1d)哌啶环上9号位质子的化学位移在1HNMR中能够被明显区分,由此设计了原位核磁共振监测实验(in-situ1HNMR spectra monitoring),探究在连续8天光照及室温条件下,suffrutines A (1a)和suffrutines B (1b)在溶液状态下的异构化过程。结果表明,无论是以1a或1b作为实验起始物,异构化过程最终都会达到一种动态平衡并且给出相似的4种几何异构体比例。并且在异构化达到平衡后,异构体1a和1b始终是含量较高的主要产物,1c和1d是含量较少的次要产物(1a (E, E):1b (Z, E):1d (Z, Z):1c (E, Z) ≈ 32 %:27 %:18 %:23 %)。同时,异构体1c和1d的纯品难以在常规实验条件下获得。据此推测4个异构体稳定性顺序为:1a (E, E) >1b (Z, E) >1d (Z, Z) >1c (E, Z)。
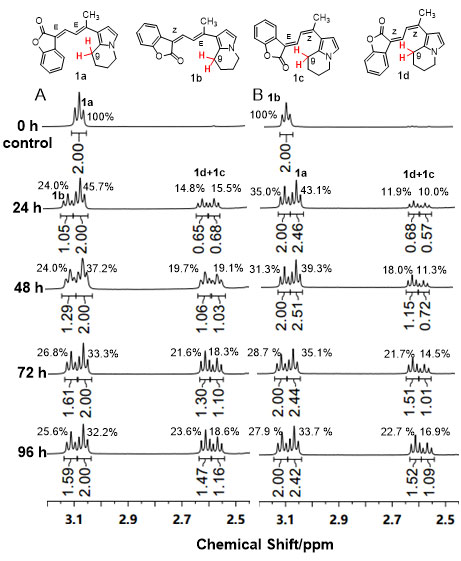
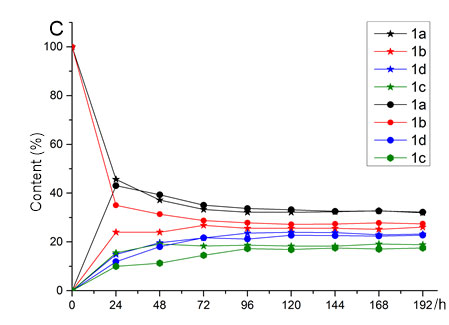
图3. 原位核磁监测实验
为进一步探索异构体之间相互转化过程,课题组采用DFT方法进行理论验算。结果如图4所示,当1a、1b、1c和1d跃迁至相应的三重态 (T1a/T1b/T1c/T1d) 后,4个异构体之间相互转化的能垒均较低,表明1a、1b、1c和1d在光照下可以自发地进行互变异构。另一方面,1a↔1b、1c→1a、1d→1b之间异构化的能垒较低,且基态时1a、1b的能量低于1c、1d(基态能量相对值:1a=0;1b=0.4;1d=0.9;1c=1.8,单位:kcal/mol)。由此揭示原位核磁监测实验中当互变异构达到动态平衡时4个几何异构体的含量比例符合预期,且异构体1c和1d的纯品在常规实验条件下相对难以获得。
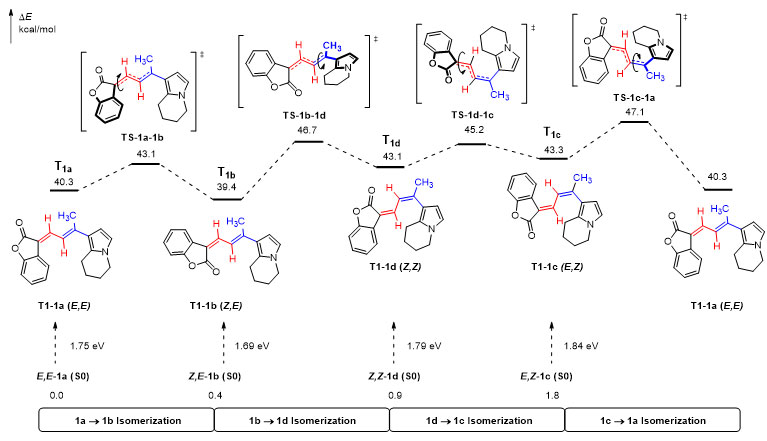
图4. Suffrutines四种异构体相互转化的能量变化图
基于上述合成工作,研究人员对suffrutines A (1a)、B (1b) 以及其含氮衍生物(2a,2b)进行体外抗肿瘤活性筛选(表1)。结果表明,1a对HeLa和MCF-7肿瘤细胞具有良好抑制作用,而1b无活性(IC50 > 30 μm);引入N原子后得到的2a、2b抗肿瘤细胞增殖活性明显提高,其中2b对MCF-7的抑制效果最强(IC50=7.31 μm)。集落形成实验显示,经14天的孵育,2a对MCF-7细胞的集落形成有显著抑制作用。细胞凋亡实验还证实suffrutines A (1a)及其含氮衍生物2a能以剂量依赖性方式诱导MCF-7肿瘤细胞凋亡(图5)。
表1. 目标化合物体外抗肿瘤活性筛选
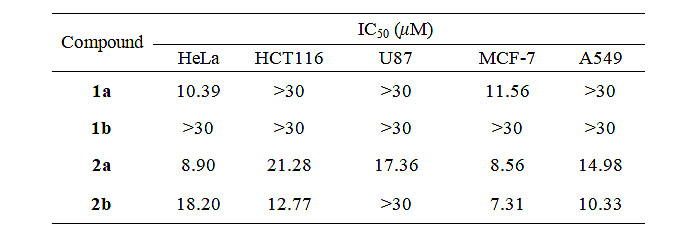
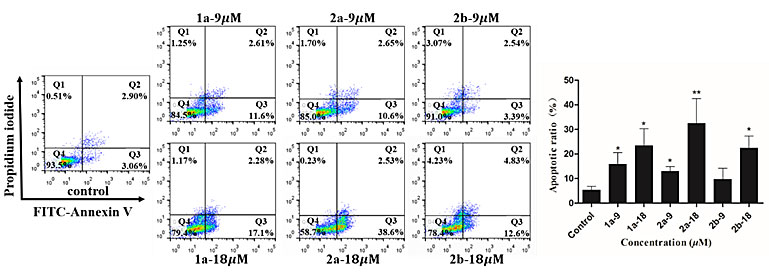
图5. MCF-7细胞凋亡诱导实验
邹永教授课题组以吡咯为原料,合成一叶萩生物碱suffrutines A、B及其含氮衍生物并首次报道其X-射线单晶衍射数据(suffrutines A除外),对4个suffrutines异构体进行光稳定性研究并进行理论验算。初步生物活性研究表明suffrutines A、B及其含氮衍生物均具有一定的抗肿瘤活性,且对天然产物进行含氮衍生化后活性有所提高。
本工作得到广东省自然科学基金重点项目的资助及陈新滋院士的指导与帮助,硕士生朱泽凤为论文第一作者,邹永教授为通讯作者。DFT计算工作得到中山大学柯卓峰教授及雷金平副教授的指导与帮助。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Synthesis and biological evaluation of suffrutines A, B and their N-fused analogues
Zefeng Zhu, Chun Chen, Jingxing Jiang, Qianzhong Zhang, Zhibo Du, Shuxian Wei, Xianheng Song, Jie Tang, Jinping Lei, Zhuofeng Ke, Yong Zou*.
Org. Chem. Front., 2020, 7, 1122-1131, DOI: 10.1039/D0QO00050G
参考文献
[1] Z.-L. Wu, B.-X. Zhao, X.-J. Huang, G.-Y. Tang, L. Shi, R.-W. Jiang, X. Liu, Y. Wang, and W.-C. Ye. Suffrutines A and B: a pair of Z/E isomeric indolizidine alkaloids from the roots of Flueggea suffruticosa, Angew. Chem., 2014, 126, 5906-5909.
[2] A. Robert, A. S. Hill, Hot off the press, Nat. Prod. Rep., 2014, 31, 1083-1087.
通讯作者简介

邹永,中山大学药学院教授。1988年本科毕业于四川大学化学系,1997年博士毕业于华西医科大学药学院药物化学专业。1997-1999年在中国科学院上海药物研究所博士后流动站从事博士后研究工作。1999-2014年在中国科学院广州化学研究所工作。2014年3月,入选中山大学“百人计划”引进人才,现任中山大学药学院教授、博士生导师。主要从事药物设计与合成;特色可再生资源的多样化转化及高值化利用;药物及天然产物绿色合成工艺及方法学研究;功能性医药精细化学品的合成及开发。在痴呆症新药盐酸美金刚的研究开发(转让项目在国内首家获得3.1类新药证书及生产批件)、系列二苯乙烯类天然产物及衍生物的研究开发、八角组份茴香脑及莽草酸多样化转化和高值化利用等方面做出创造性贡献。
https://www.x-mol.com/university/faculty/18501
邹永教授课题组长期招收博士后,待遇从优。
邹永教授邮箱:
zouyong3@mail.sysu.edu.cn
zou_jinan@163.com
 0
0












