2-羟基联芳基单元是许多生物学和有机合成中重要的核心部分(图1a),其刚性结构和氢键性质与天然产物和合成药物的生物活性有关,其中一些天然产物具有抗疟疾、抗病毒或抗细胞毒性的特性。与脂肪醇相比,酚羟基是较好的氢键供体和较差的氢键受体,并且其供体性既可以通过取代酚环本身调节,也可以通过与侧链芳环的空间相互作用来调节。目前,2-羟基联芳基的合成方法主要是过渡金属催化的羟基芳烃的芳基化,即通过交叉偶联或C-H键官能团化实现。然而,这些方法的原子经济性和步骤经济性较低。上个世纪80年代,Barton, D. H. R. 等人首次报道了Bi(V)介导的苯酚和萘酚的氧化芳基化反应,并且不需要底物的预官能团化(图1b,J. Chem. Soc. Chem. Commun., 1980, 246–247; J. Chem. Soc. Chem. Commun., 1980, 827–829)。然而,Bi(V)和Bi(III)试剂却很少用于C–H键芳基化反应,这主要有以下几方面原因:1)芳基铋试剂需要多步合成;2)底物控制的邻位芳基化(Cortho-arylation)与氧化芳基化(O-arylation)的化学选择性无法预测;3)仅转移Ar3BiX2其中一个芳基;4)缺乏对反应范围或机理的系统研究。
日前,英国诺丁汉大学的Liam T. Ball教授(点击查看介绍)课题组报道了Bi(V)介导的苯酚和萘酚的C-H键芳基化,其中关键在于使用稳定的Bi(III)前体,在易得的硼酸试剂的存在下,通过“硼至铋(boron-to-bismuth, B-to-Bi)”转金属化和氧化反应原位生成具有独特反应性的Bi(V)芳基化试剂。该反应可在温和条件下实现各种芳基、杂芳基与苯酚和萘酚的偶联,为合成2-羟基联芳基单元提供了一条简单高效的策略。值得一提的是,芳基化后的Bi(III)前体能够以高收率回收,并可重复使用。相关成果发表在Nature Chemistry 上。
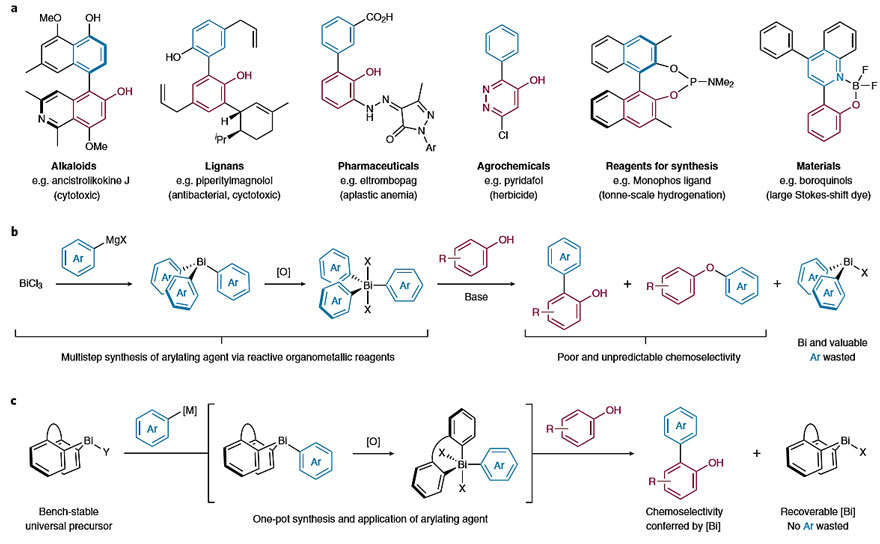
图1. Bi(V)介导的2-羟基联芳基合成。图片来源:Nat. Chem.
如图1c所示,作者设想将三芳基铋烷的两个芳环连接,通过模块化的一锅法转金属化/氧化顺序,从稳定的通用铋(III)前体原位制备铋(V)芳基化试剂。Suzuki, H. 先前曾报道过砜桥双环化合物在模型转金属化、氧化和C-H键芳基化反应中具有独特的能力(图2,J. Chem. Soc. Perkin Trans., 1992, 1, 1593–1600)。受此启发,作者合成并分离了铋环对甲苯磺酸盐1-OTs,无需柱色谱纯化,便能以十克级规模制备(11 g,两步收率93%)。该化合物可以在空气、水或光照的条件下进行处理和储存,并且在室温下储存两年仍不会分解。其固态结构分析表明铋中心与砜的一个氧原子之间有一个短的跨环接触(Bi⋯O = 2.556(5)Å),这很可能是其优异稳定性的原因。
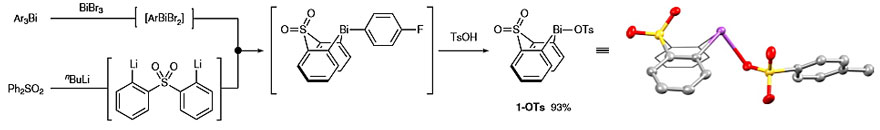
图2. 稳定的通用铋(III)前体1-OTs的合成。图片来源:Nat. Chem.
接下来,作者研究Bi(III)中心的转金属化过程。尽管金属有机试剂(ArLi、ArMgX、ArZnX)可实现Bi(III)的转金属化,但鉴于芳基硼酸(酯)易处理、易获得,作者选择了芳基硼酸供体。对不同的芳基硼试剂和反应条件进行优化,最终确定了B-to-Bi转金属化反应的最佳条件(图3)。在此基础上,作者对底物范围进行了考察,具有不同电性(2a–2l)和位阻(2m–2p)的芳基硼酸、杂芳基(2t–2aa)硼酸都能兼容该反应,均具有优异的产率。值得注意的是,尽管相应的硼酸对质子脱硼有敏感性,但多氟苯基单元可以平稳地转移并提供稳定的、可分离的芳基铋环化合物(2q-2s)。用先前的方法制备含有芳基碘化物(从芳基重氮盐的收率为21%)和芳基酯的三芳基铋烷的收率较低(四步总收率为26%),而通过该方法两者均可一步法定量制备(2h、2i)。同样,也能够以优异的收率(2t–2z,> 99%)制备含噻吩、呋喃、吡咯或吲哚的三芳基铋烷。
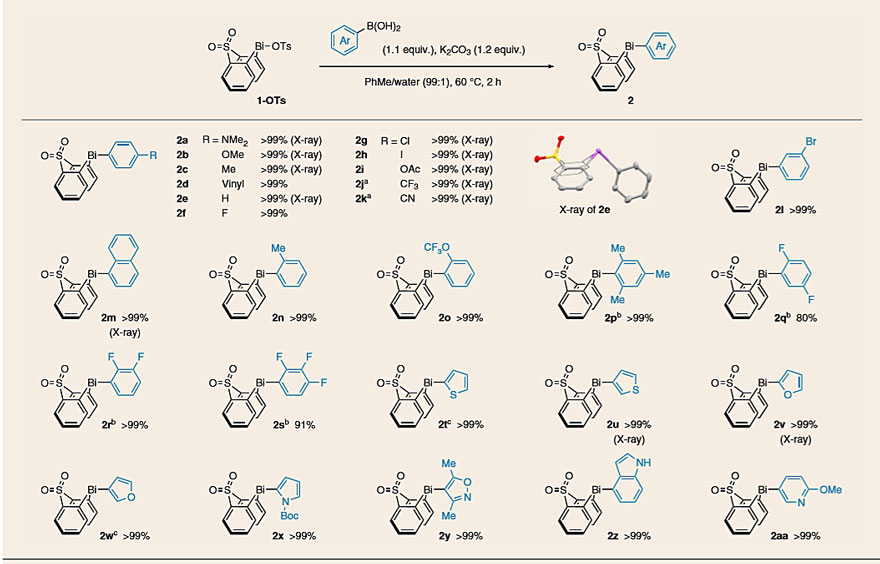
图3. 从芳基硼酸和杂芳基硼酸转金属化至1-OTs。图片来源:Nat. Chem.
接着,作者研究了氧化和芳基化步骤。市售mCPBA无需纯化即可一锅法进行转金属化、氧化和芳基化(图4a)。值得注意的是,副产物铋环间氯苯甲酸盐1-OmCB,只需用乙酸作为共洗脱剂,通过柱色谱法便可以优异的收率回收铋环乙酸盐(1-OAc)。对于芳基硼酸类化合物,无论带有给电子取代基(3-7)、吸电子取代基(9-15)、空间位阻较大的取代基(16、17)还是在合成上有用的取代基(6、7、10、12、13),均具有良好的耐受性,以中等至较高的收率实现2-萘酚的选择性C-H键芳基化(图4b)。铋环骨架可提高反应的活性:即在转金属化和氧化后,2-萘酚的芳基化反应可在室温下数秒内完成,且无需额外的碱。此外,几种杂芳基硼酸也能够兼容该反应,以较好的收率得到目标产物(18-20),但是极富电子的杂芳基硼酸则不能兼容该反应(如2-呋喃硼酸)。对于2-萘酚类化合物,无论是给电子取代还是吸电子取代,都能以较高的收率实现芳基化且具有优异的区域选择性和(Cortho-vs-O)化学选择性(图4c,21-25)。该方法同样也适用于杂环萘酚衍生物(27–30)。此外,合成上有用的官能团如溴、碘、硼酸酯(13、22–24)也能耐受该反应,进一步说明了其与常规交叉偶联和C–H键官能化的互补性。尽管先前报道的方法实现1-萘酚芳基化的收率较低,但是该方法能以86%的收率实现其芳基化(26)。对于苯酚类化合物,同样观察到反应性增强(图4d,31-42)。中等缺电子和极富电子的底物均能以中等至较好的收率得到目标产物(31-34),而极度缺电子的苯酚(如4-硝基苯酚、4-氰基苯酚等)则不会发生芳基化反应。间位取代的苯酚类衍生物会形成区域异构体混合物(35–40),例如3-氟苯酚的芳基化反应(2位-和6位-电性不同但位阻相似)具有中等的区域选择性(2.6:1;35:35ʹ);对于2位-和6位-位阻不同但电性相似的底物,也观察到中等的区域选择性(3.4:1; 36:36ʹ)。其他苯酚的芳基化(37-40)证明了该反应倾向于更富电子、位阻更小的位点进行芳基化。
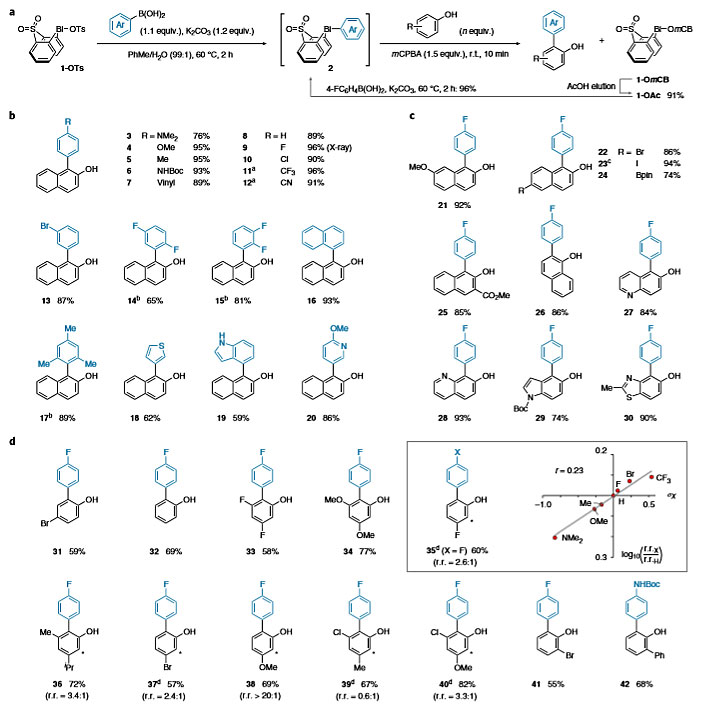
图4. 底物扩展。图片来源:Nat. Chem.
另外,该方法还可以用于白三烯B4受体激动剂43和大麻素模拟物44的合成以及雌酮45和萘普生衍生物46的后期修饰(图5)。鉴于2位-和4位-芳基雌酮均具有生物活性,因此一锅法得到两种区域异构体使其在药物发现中具有潜在的实用性。值得一提的是,Bi(V)介导的芳基化还可以进行衍生化,如中间体47通过交叉偶联合成雌激素受体激动剂48和β-HSD1抑制剂49(仅需三步,收率> 90%),而之前报道的方法需要七步才能实现其合成。
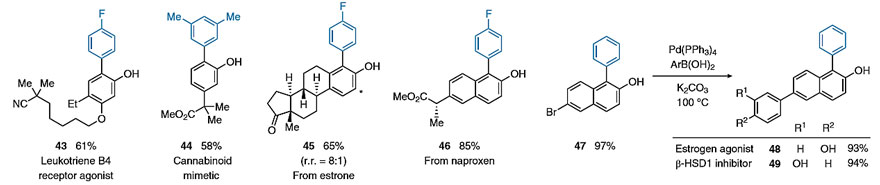
图5. Bi(V)介导的生物活性化合物的芳基化。图片来源:Nat. Chem.
接下来,作者对反应机理进行了研究。电中性或富电子硼酸与1-OTs的转金属化可在2 h内完成,且没有可观察到的中间体。相反,氰基和三氟甲基取代的苯硼酸需要6 h才能完成反应,并在芳基铋环2j或2k形成之前积累不确定的物种混合物。于是,作者在没有硼酸的情况下使1-OTs发生转金属化生成中间体混合物(图6a)。分离后得到μ-氧桥联的二聚体12O,其在痕量水的存在下与相应的单体氢氧化铋1-OH处于平衡。在没有碱的情况下,二聚体12O与4-氟苯硼酸在室温下反应1 min,就能定量地得到芳基铋环2f,这意味着1-OH/12O是动力学上有效的中间体。对于缺电子的硼酸,这些Bi-oxo物种的积累表明在整个转金属化过程中,决速步取决于底物的变化。用市售mCPBA(~75%纯度)氧化芳基铋环2f,得到的混合物用碱处理后,可以分离出双(μ-氧代)桥联的二聚体50(图6b),X-ray晶体学研究揭示固态下铋呈扭曲的三角双锥几何形状(图6c)。用mCBA滴定该二聚体,光谱鉴定分别为Bi(V)羟基苯甲酸盐51和Bi(V)二苯甲酸盐52。Bi(V)物种50-52对苯酚表现出不同的反应性:50不能与苯酚发生芳基化,在1 min内还原至2f;51与1当量的苯酚反应数秒就可定量得到预期的Cortho-芳基化产物;而52对苯酚没有反应性。这些结果表明Bi(V)羟基苯甲酸盐51是具有动力学作用的芳基化试剂,其碱性氢氧化物促进了关键中间体Bi(V)酚羟基苯甲酸盐54的形成(图6e)。另外,作者进行了竞争动力学同位素效应(KIE)来研究Bi(III)→Bi(V)氧化的关键产物形成过程(图6f、6g)。初步研究了不同酚之间的竞争(ρ+ = -1.4),证明了该步骤涉及酚氧对Bi(V)物种的进攻。分子内竞争的α-SKIE(二级动力学同位素效应)为0.83,这表明随后的C-C键形成步骤涉及到在快速重芳构化之前进行苯酚的选择性去芳构化(图6g)。总之,这些初步实验结果为Bi(V)中心的还原配体偶联涉及的基本步骤提供了独特的见解。具体而言:(1)在进攻Bi(V)物种时确定酚类混合物之间的选择性,较富电子的酚优先芳基化;(2)非等效Cortho位置之间的区域选择性是在C–C键形成时确定的,有利于空间位阻较小、较富电子的Cortho位,并且仅对要安装的芳基的电性敏感。
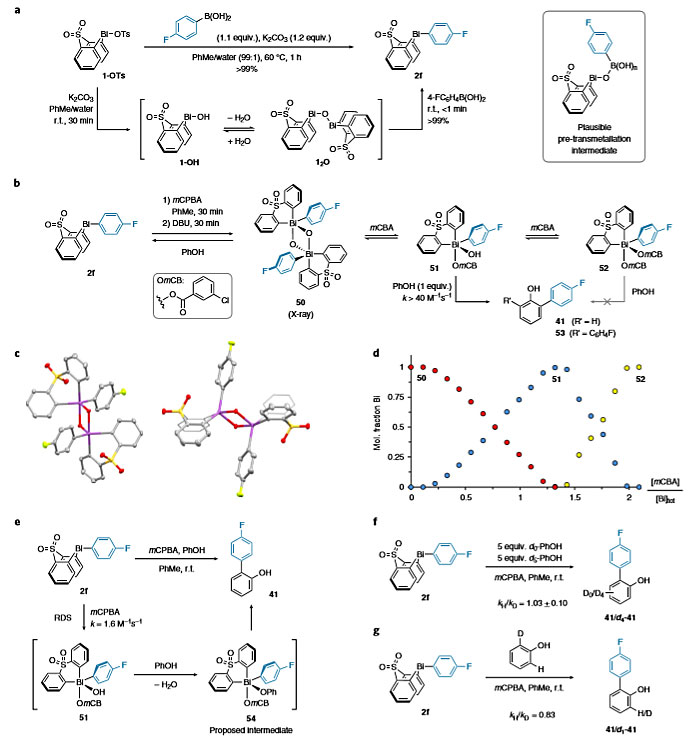
图6. 机理研究。图片来源:Nat. Chem.
总结
Liam T. Ball教授课题组发展了一种Bi(V)介导的苯酚和萘酚的邻位芳基化,该反应条件温和,底物范围广,官能团耐受性好,原子经济性、步骤经济性高,为2-羟基联芳基单元的合成提供了一条高效的途径。此外,该方法不仅可以应用于合成中,也为其他铋介导的芳基化反应奠定了基础。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Modular bismacycles for the selective C–H arylation of phenols and naphthols
Mark Jurrat, Lorenzo Maggi , William Lewis, Liam T. Ball
Nat. Chem., 2020, 12, 260-269, DOI: 10.1038/s41557-020-0425-4
导师介绍
Liam T. Ball
https://www.x-mol.com/university/faculty/40835
 0
0










