在芳香环上安装甲基是药物研发过程中最常用的一种策略,有助于提高其结合亲和力、生物利用度和代谢稳定性(图1A),从而被药物化学家称为“神奇的甲基效应(magic methyl effect)”。因此,在温和的条件下选择性地安装甲基具有广泛的应用价值。其中过渡金属催化的交叉偶联反应是位点选择性地构建碳-碳键的最可靠和模块化的方法之一。然而,大多数方法都依赖于剧毒的烷基化试剂或高反应性的有机金属试剂,从而与生物活性小分子中常见官能团存在兼容性的问题。
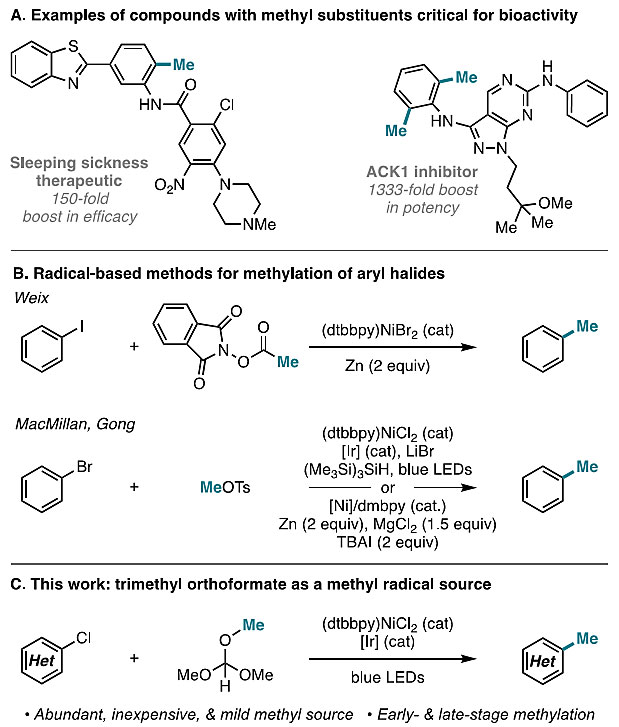
图1. 研究背景及本文的工作。图片来源:J. Am. Chem. Soc.
近年来,化学家通过基于自由基的方法实现了C(sp3)-C键交叉偶联。例如杂芳烃与多种甲基自由基源(如乙酸、过氧乙酸叔丁酯、过氧化二枯基、甲烷和甲醇)的Minisci型甲基化反应,但这些方法仅适用于缺电子的杂芳烃,并且适用性有限。在此基础上,化学家们发展了一些基于自由基的芳基卤化物的甲基化反应(图1B)。例如,Weix课题组报道了镍催化的芳基碘化物的烷基化反应(J. Am. Chem. Soc., 2016, 138, 5016-5019);MacMillan课题组通过将镍/光氧化还原催化与超级硅烷试剂结合,实现了芳基溴化物和烷基溴化物之间的交叉偶联(J. Am. Chem. Soc., 2016, 138, 8084-8087);上海大学龚和贵课题组也报道了对甲苯磺酸甲酯用于镍催化的芳基溴化物和对甲苯磺酸酯、烷基卤化物和酰氯的甲基化反应(Chem. Commun., 2017, 53, 10180-10183; Org. Lett., 2014, 16, 5620-5623)。尽管这些方法适用性强,但仍然需要准备甲基自由基源或使用亲电性甲基化试剂。

图2. 计算结果及初步实验结果。图片来源:J. Am. Chem. Soc.
近年来,普林斯顿大学的Abigail G. Doyle教授(点击查看介绍)课题组一直致力于发展镍/光氧化还原催化的含氯亲电试剂和C(sp3)-H键的交叉偶联反应(J. Am. Chem. Soc., 2016, 138, 12719−12722; Angew. Chem. Int. Ed., 2017, 129, 7297-7300; J. Am. Chem. Soc., 2018, 140, 14059-14063)。其中含氯亲电试剂既充当偶联体,又充当通过氢原子转移(HAT)活化C(sp3)-H键的氯自由基来源。于是,他们设想能否利用该体系实现(杂)芳基氯化物的甲基化?近日,他们实现了镍/光氧化还原催化的(杂)芳基氯化物的甲基化(图1C),其中原甲酸三甲酯是甲基自由基的来源。该反应条件温和、底物范围广且官能团耐受性好。相关成果发表在J. Am. Chem. Soc. 上。
为了评估原甲酸三甲酯作为甲基自由基来源的可行性,作者研究了4'-氯苯乙酮与原甲酸三甲酯的偶联反应(图2B)。除了得到所需的甲苯3(产率38%),也形成了另外两种产物:酯产物2(产率8%),是由原甲酸三甲酯的叔位偶联引起的;苄基醚产物1(产率27%),由伯位C-H键偶联引起的。
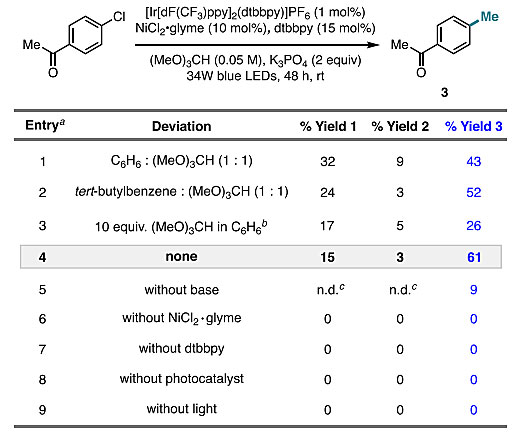
图3. 反应条件优化。图片来源:J. Am. Chem. Soc.
为了提高反应的产率和选择性,作者对反应条件进行了优化。当使用NiCl2•glyme作为镍源时,收率有所提高(43%)。当使用叔丁基苯作为反应的助溶剂时,3的收率和选择性均有所提高,这可能是由于富电子的溶剂对氯自由基的稳定性更高。值得注意的是,在无助溶剂的原甲酸三甲酯中进行反应时,可最大程度地提高反应的收率(61%)和选择性(3:1 = 3.9:1)。且酯的生成量最小(收率:< 5%)。对照实验表明反应中的任一组分都是必不可少的。
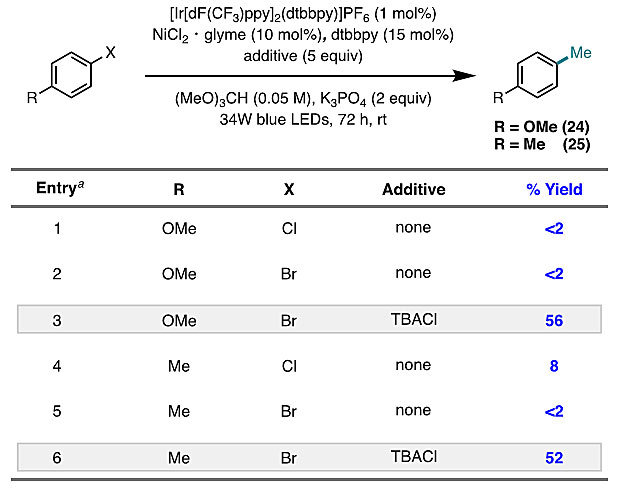
图4. 芳基溴代物的甲基化。图片来源:J. Am. Chem. Soc.
在最优条件下,作者考察了反应的底物范围(图5A)。通常情况下,缺电子芳基氯化物比富电子芳基底物的产率更高,这与它们对Ni(0)氧化加成的相对反应性一致。与采用反应性亲核或亲电甲基化试剂的方法不同,该反应能够耐受各种敏感官能团,例如酮(3、4)、腈(5、6)、醛(7)、酯(8)。对于邻位取代的芳基氯化物(5、11),也能以中等至良好的收率得到甲基化产物。此外,在交叉偶联位点远端含有杂芳基官能团的底物也能实现甲基化,包括吡啶(13、16、17)、呋喃(14)、吡咯(15)。复杂的芳基氯化物如氯雷他定(19)、非诺贝特(20)、佐美酸(21)、奋乃静(22)均能以高收率得到相应的甲基化产物,表明该方法适用于生物活性分子的后期官能团化。含有两个化学等价的芳基氯化物的嘧啶酮经过选择性的单甲基化反应后,以55%的收率得到23,这可能是由于催化体系对电子效应的敏感性所致。值得一提的是,该方法的主要副产物(苄基醚)来自于芳基氯化物的烷氧基甲基化,因此将反应进行Pd/C氢解,便可将副产物转化为甲基化产物,从而提高甲基化的收率(19和20)。鉴于富电子的芳基氯化物的甲基化收率较低,作者尝试使用芳基溴化物作为底物,然而并未观察到甲基化,大概是因为弱的H-Br键(BDE = 88 kcal/mol)使源于溴自由基的HAT较为不利。值得一提的是,通过使用芳基溴化物和外来氯化物添加剂进行卤化物交换便可提高反应活性,分别以56%和52%的收率得到24和25(图4)。接下来,作者考察了杂芳基氯化物的底物范围(图5B)。各种含氮、氧和硫的杂芳基氯化物均能以中等至良好的收率进行甲基化,例如吡啶(26-29)、喹啉(30-34、42)、喹喔啉(35)、喹唑啉(41)、嘧啶(36-37)、噻吩(38-39)和噻唑(40)。值得注意的是,该方法可以在Minisci型反应无法实现的位点上进行甲基化,例如,在喹啉的3位、6位和7位(分别为32、33和34)以及吡啶(27-29)的氮原子间位进行位点选择性甲基化。具有生物活性的杂芳基氯化物如依托昔布(43),也能以良好的收率进行甲基化。
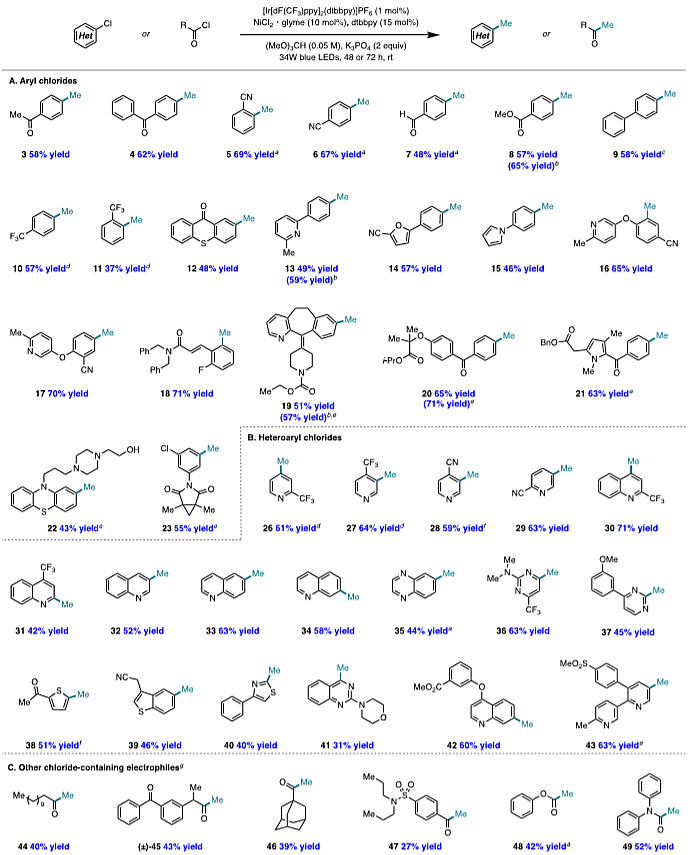
图5. 杂芳基氯代物的甲基化。图片来源:J. Am. Chem. Soc.
与传统的方法相比,将该甲基化条件应用于酰氯能更温和地合成脂肪族和芳香族甲基酮。令人欣慰的是,采用优化的甲基化条件可从一级(44)、二级(45)、三级(46)和芳基(47)酰氯制备甲基酮。该方法还可适用于酮洛芬(45)和丙磺舒(47)制备的酰氯。此外,还可以由相应的氯甲酸酯和氨基甲酰氯制备酯(48)和叔酰胺(49)。

图6. 机理研究及可能的机理。图片来源:J. Am. Chem. Soc.
根据先前的机理研究,作者认为从Ni(III)中间体52进行光消除生成的氯自由基会介导与原甲酸三甲酯的HAT过程(图6A)。甲基化产物3、酯产物2和苄基醚产物1 为Ni催化的交叉偶联反应中HAT引发的过程提供了初步支持。当在标准条件下与1当量的TEMPO进行4'-氯苯乙酮的甲基化反应时,并没有观察到这三种产物,从而为有机自由基中间体提供了进一步证据。随后,作者通过ReactIR监控了反应过程。结果显示,随着4'-氯苯乙酮的消耗,碳酸二甲酯和4'-甲基苯乙酮(3)的生成比例为1:1。定量13C NMR实验也证实了这一现象,并且两个实验结果都表明了整体的非零级动力学。
此外,Ni(II)(Ar)物种53介导的原甲酸三甲酯(B)的叔自由基的氧化,将Ni(I)-X传递给氧鎓中间体(56,图6D),从而产生Ni(III)中间体54和碳酸二甲酯。根据β-裂解机理,在不存在镍的情况下,可以用原甲酸三甲酯进行甲基化。实际上,当乙烯基膦酸二乙酯与过氧化苯甲酰在原甲酸三甲酯中于80 ℃反应时,甲基化的Giese产物57的产率为22%(图6E)。综上所述,这些实验结果证实了原甲酸三甲酯通过β-裂解机理产生甲基自由基。此外,原甲酸三烷基酯可以用作脂肪族自由基的来源。例如,将该反应中的溶剂变为原甲酸三乙酯或原甲酸三异丙酯即可得到相应的烷基化产物58或59(图7A)。
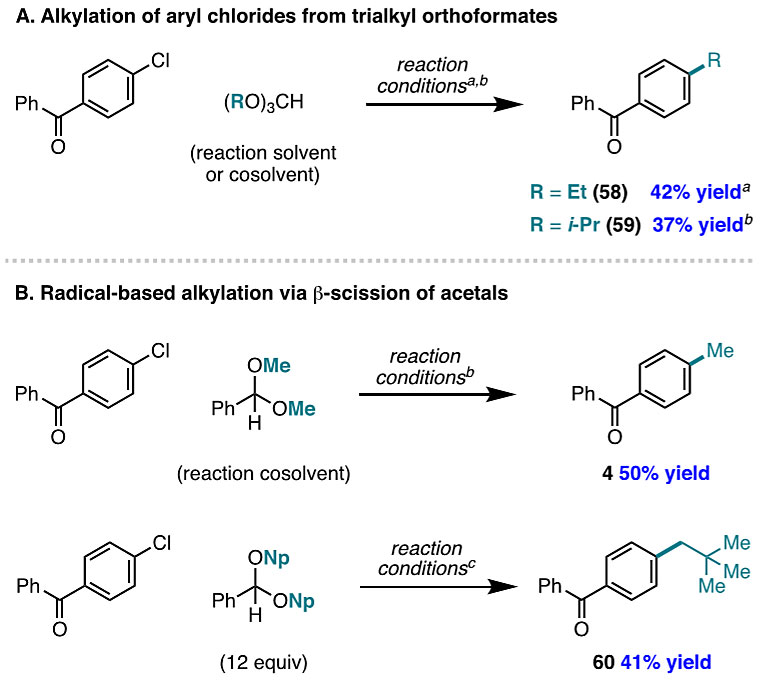
图7. 用三烷基原甲酸酯或者缩醛的烷基化。图片来源:J. Am. Chem. Soc.
随后,作者尝试使用缩醛作为脂肪族自由基的来源。在初步的研究中,作者发现用苯甲醛二甲缩醛/苯(1:1)代替原甲酸酯便可以50%的收率得到甲基化产物4(图7B)。此外,4-氯二苯甲酮与12当量的苯甲醛二新戊基缩醛反应时,以41%的收率得到烷基化产物60。
总结
Doyle课题组发展了一种Ni/光氧化还原的方法,实现了含氯亲电试剂的位点选择性甲基化,反应的特别之处在于使用原甲酸三甲酯作为丰富、无毒且与官能团兼容性好的甲基化试剂。机理研究表明,原甲酸三甲酯是甲基自由基的来源。该方法为获取低分子量脂肪族自由基提供了新的方法,有望在制药行业中得到广泛的应用。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Nickel/Photoredox-Catalyzed Methylation of (Hetero)aryl Chlorides Using Trimethyl Orthoformate as a Methyl Radical Source
Stavros K. Kariofillis, Benjamin J. Shields, Makeda A. Tekle-Smith, Michael J. Zacuto, Abigail G. Doyle
J. Am. Chem. Soc., 2020, 142, 7683-7689, DOI: 10.1021/jacs.0c02805
导师介绍
Abigail G. Doyle
https://www.x-mol.com/university/faculty/651
 0
0