注:文末有研究团队简介 及本文作者科研思路分析
不对称催化合成之所以会迅猛发展就在于:手性分子的相对和绝对构象会直接影响其生物活性。此外,合成药物的所有立体异构体可以作为标准品用于评价药物生产的纯度。因此,对潜在药物的所有的立体异构体进行治疗和毒理学评价已经成为监管机构要求的主要内容之一。目前,通过选择手性催化剂的构型构建单个手性中心化合物的两种对映异构体是相对容易实现的工作。并且,化学家可以通过调整多种结构因素,如电子、空间和诱导效应来控制含有两个或多个手性中心化合物的非对映选择性。但是,这些方法主要用于合成非对映异构体(顺式或反式),若需要合成含有两个或者多个手性中心化合物的所有立体异构体,一般通过改变底物、催化剂(包括改变金属离子和配体或者调控配体的电性和位阻)、反应条件(包括改变反应温度或者溶剂)或通过设计新的反应来实现。非天然的α,α-双取代α-氨基酸在生物化学和药物研究中起着非常重要的作用,尤其是含有相邻手性中心的α,α-双取代α-氨基酸广泛存在于具有生物活性的天然产物和药物分子结构中。这些α-氨基酸的生物活性很大程度取决于其绝对和相对的立体构型。因此,开发简便、可预测的方法学用于合成目标产物的所有立体异构体不仅能够获得不同生物活性的氨基酸,也有利于研究其结构-活性关系,从而加快药物的发现和发展进程。到目前为止,大部分方法都是通过改变添加剂或不同的催化剂来解决这一问题。如何使用同样的原料在相同的反应条件下任意地构建产物的所有立体异构体一直以来都是挑战性的课题。
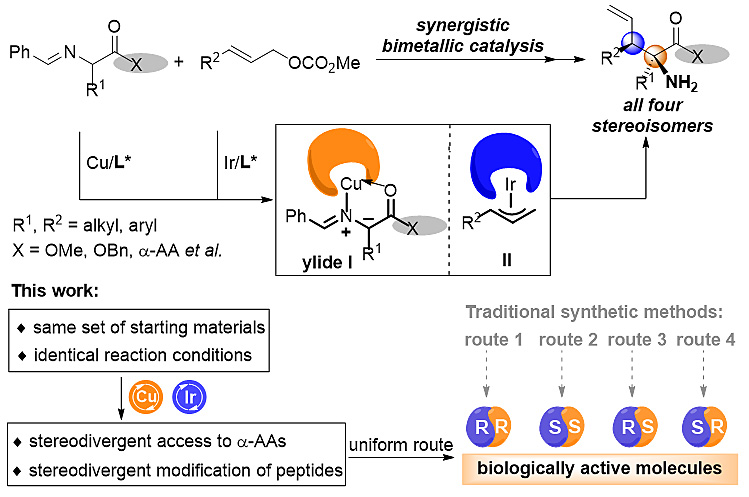
相邻手性中心的α,α-双取代α-氨基酸的立体发散性合成
相比之下,协同催化策略可能会提供另外一种思路:如果两种手性催化剂分别独立控制产物中手性中心的立体构型,理想情况下可以在相同的反应条件和原料下通过选择两种催化剂构型组合来选择性地合成任意一种非对映异构体,即在相同的反应条件和原料下立体发散性地合成所有非对映异构体。
上海交通大学的张万斌教授(点击查看介绍)课题组长期致力于协同催化体系的开发,并将该策略用于不对称烯丙基取代反应中。最近几年,该团队成功开发了过渡金属钯、有机分子催化剂和具有氢键作用的醇溶剂的协同催化反应体系(Chem. Soc. Rev., 2015, 44, 7929; Chem. Rec., 2016, 16, 2687)。该催化体系可以成功将含有惰性离去基团的烯丙基胺、烯丙醇和烯丙醚用于简单酮的烯丙基反应中(J. Am. Chem. Soc., 2011, 133, 19354; Angew. Chem. Int. Ed., 2014, 53, 6776; Org. Lett., 2014, 16, 1570; Chem. Commun.. 2017, 53, 5151)。与有机及金属协同催化体系的快速发展相比,手性双金属协同催化体系具有更广的应用范围和更为高效的协同效果,但这方面的研究还非常少。最近,该团队围绕双金属协同催化体系开展了一系列的研究工作(Invited review: Org. Biomol. Chem., 2017, 15, 9747)。2016年,该研究团队报道了首例基于双手性金属催化策略的立体发散化学新反应,即开发了含有手性亚磷酰胺配体修饰的铱催化剂和手性氨基醇修饰的锌催化剂组成的双金属协同催化体系,用于羟基酮的立体发散性烯丙基化反应(J. Am. Chem. Soc., 2016, 138, 11093; Org. Lett., 2017, 19, 5513)。随后,该团队又开发了Pd/Cu双金属协同的催化反应,并将其直接用于氨基酸和寡肽的不对称烯丙基化修饰(J. Am. Chem. Soc., 2017, 139, 9819; Chem. Commun., 2018, 54, 599)。
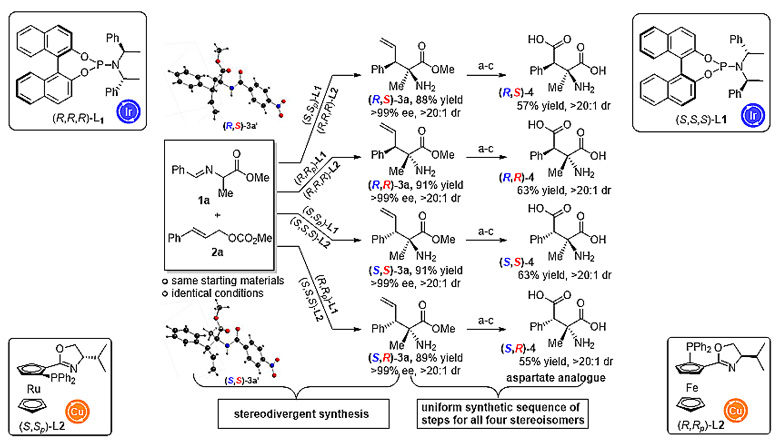
立体发散性合成天冬氨酸类似物
考虑到双金属催化体系在反应开发和立体控制等方面的独特优势,最近,该团队又成功开发了第二例可用于立体发散性合成的Ir/Cu双金属协同催化体系,并将其用于非天然α-氨基酸的立体选择性合成。一系列烯丙基底物和醛亚胺酯都可以顺利用于该催化体系,取得了最高96%的产率,> 99%的立体选择性和> 20:1的非对映选择性。此外,催化产物通过简单的转化可以用于天冬氨酸类似物的立体发散性合成,该类化合物作为一种谷氨酸转运体的亚型选择性阻断剂,可以调节哺乳动物的中枢神经系统(J. Am. Chem. Soc., 2018, 140, 2080)。
值得注意的是,几乎同时,武汉大学的王春江教授和加州大学伯克利分校的Hartwig教授也分别报道了可用于立体发散性合成的Ir/Cu双金属协同催化体系(J. Am. Chem. Soc., 2018, 140, 1508; J. Am. Chem. Soc., 2018, 140, 1239)。这一成果近期发表在Journal of the American Chemical Society 上,文章的第一作者是上海交通大学的博士后霍小红。
该论文作者为:Xiaohong Huo, Jiacheng Zhang, Jingke Fu, Rui He and Wanbin Zhang
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Ir/Cu Dual Catalysis: Enantio- and Diastereodivergent Access to α,α-Disubstituted α-Amino Acids Bearing Vicinal Stereocenters
J. Am. Chem. Soc., 2018, 140, 2080, DOI: 10.1021/jacs.8b00187
张万斌教授简介

张万斌,上海交通大学化学化工学院特聘教授;1997年在日本大阪大学取得博士学位;1997年至2001年在日本大阪大学工学部应用化学系任助理教授;2001年至2003年在日本三菱化学株式会社横滨综合研究所任主任研究员;2003年就职于上海交通大学任教授;2013年被聘为校特聘教授。
张万斌的研究领域是:(1)有机合成及不对称催化;(2)药物及其关键中间体的高效合成方法;在相关领域发表SCI论文200余篇,包括J. Am. Chem. Soc.、Angew. Chem. Int. Ed.、Chem. Rev.、Chem. Soc. Rev. 等;获授权发明专利20余项,参与撰写三本英文书籍;研究成果曾被Chinese Journal of Organic Chemistry、C&EN、SYNFACTS、organic-chemistry.org. 等专题报道;主持和参加国家自然科学基金重点、重点国际合作和面上项目、国家“重大新药创制”科技重大专项、教育部优秀青年教师资助计划项目、上海市科委、经信委和教委重大和重点科技攻关项目以及与国内外多家企业的产学研合作项目等多项课题研究;有多项成果获得了工业化应用,“青蒿素的高效合成”入选2012年国内十大科技新闻和2012年上海市十大科技成果。
导师介绍
张万斌
http://www.x-mol.com/university/faculty/12592
课题组网站
http://wanbin.sjtu.edu.cn/index.htm

科研思路分析
Q:这项研究最初是什么目的?或者说想法是怎么产生的?
A:如上所述,非编码光学活性的α,α-二取代α-氨基酸是有机合成和药物研发中一类非常重要的有机合成中间体,同时对多肽结构的后期修饰成为一种必要且灵活的方法,用于开发和研究新型的多肽药物。我们课题组长期从事协同催化体系的研究,并将其应用于烯丙基取代反应中的研究,因此想开发一种可应用于立体发散性合成的新型双金属协同催化体系,用于非天然的α,α-双取代α-氨基酸的立体选择性合成。
Q:研究过程中遇到哪些挑战?
A:该课题研究过程中最大的挑战是:(1)如何提高该反应的活性以及控制前手性亲核试剂的立体选择性;(2)两个连续手性中心非对映选择性的控制一直是一个难题;(3)寻找合适的双金属协同催化体系,既可以保证反应的活性、立体选择性和非对映选择性,又可以通过改变金属催化剂的立体构型来调控产物的立体构型;(4)尽管过渡金属催化的不对称反应已经取得了重要进展,但利用过渡金属对小分子肽类的立体选择性修饰构建两个相邻的手性中心依然没有报道,主要是由于我们对多肽的性质(肽的位阻和反应位点等)还不甚了解。
Q:该研究成果可能有哪些重要的应用?哪些领域的企业或研究机构可能从该成果中获得帮助?
A:药物学家或者生物学家可以通过该方法快速构建一系列光学纯的含有两个立体中心非天然氨基酸的所有立体异构体,也可以对多肽结构进行选择性修饰,有望加速药物研发的进程。
 0
0










