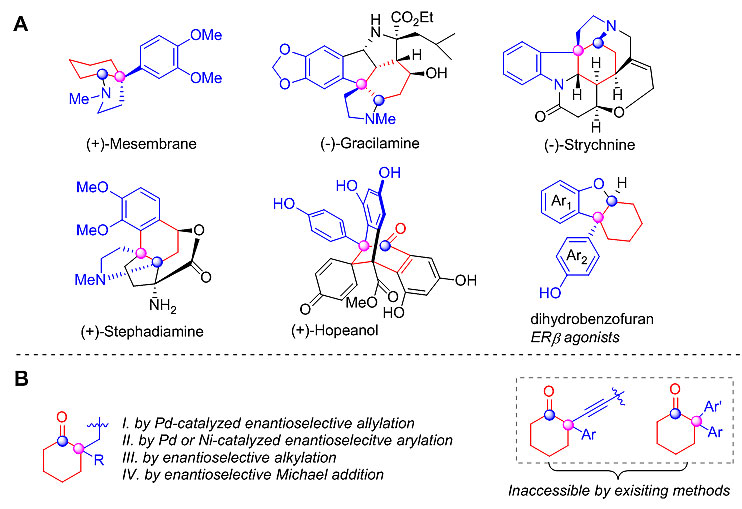
含手性季碳中心的环己烷骨架广泛存在于众多天然产物和药物活性分子中,如mesembrane、gracilamine、strychnine、stephadiamine、hopeanol、dihydrobenzofuran等(下图A)。而2-芳基-2-烷基、2,2-二芳基取代的手性环己酮化合物显然是合成这些化合物的最佳起始原料。目前构建此类化合物的方法大多集中在钯催化的烯丙基化反应、钯或镍催化的芳基化反应、有机催化的烷基化和Michael加成反应。尽管这些构建方法较为高效,然而底物范围仍然有限,例如不对称催化合成2-炔基-2-芳基环己酮和2,2-二芳基环己酮类化合物的方法至今仍未见报道(下图B)。
近年来,瑞士洛桑联邦理工学院(EPFL)的祝介平(点击查看介绍)团队(LSPN)发展了一系列不对称催化亲核重排反应,如手性有机催化的不对称插烯频哪醇重排(Angew. Chem. Int. Ed., 2016, 55, 15411)和acyloin重排(Angew. Chem. Int. Ed., 2017, 56, 5858)、手性路易斯酸催化的不对称α-ketol重排(Angew. Chem. Int. Ed., 2019, 58, 499)和多米诺芳基化/半频哪醇重排(Chem. Eur. J., 2017, 23, 13037)。近日,该小组报道了手性布朗斯特酸催化的频哪醇重排和Meinwald重排反应用于高效构建含全碳手性季碳中心的环己酮化合物,并实际应用于天然产物(+)-mesembrane的简捷合成(见下图)。这一研究成果近期发表在J. Am. Chem. Soc.上,文章的第一作者为吴华博士。
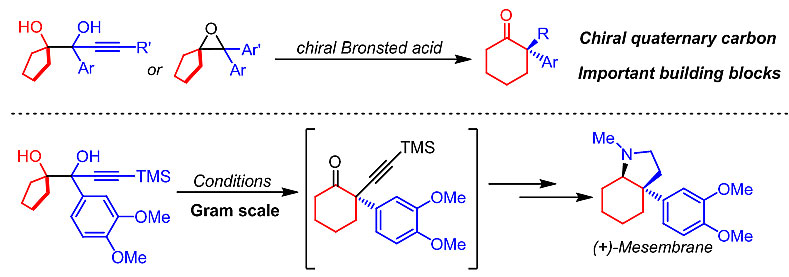
作者利用1,2-二叔醇化合物作为起始原料,手性布朗斯特酸作为催化剂,在温和的反应条件下,实现了不对称催化频哪醇重排反应,高效地合成了一系列手性2-炔基-2-芳基环己酮类化合物;作者以四取代的环氧化合物作为起始原料,在相同催化剂作用下,实现了不对称催化Meinwald重排反应,高效地制备了2,2-二芳基环己酮类化合物。另外作者发现,环氧化合物的重排活性要远远高于相应的1,2-二醇化合物;底物中的富电子芳基对于反应活性和对映选择性起着至关重要的作用。该工作首次将不对称催化频哪醇重排应用于手性季碳构建;首次实现了高对映选择性的不对称催化Meinwald重排反应。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Catalytic Enantioselective Pinacol and Meinwald Rearrangements for the Construction of Quaternary Stereocenters
Hua Wu, Qian Wang, Jieping Zhu*
J. Am. Chem. Soc., 2019, 141, 11372, DOI: 10.1021/jacs.9b04551
导师介绍
祝介平
https://www.x-mol.com/university/faculty/2766
 0
0










