光学纯的手性α-三级胺片段广泛存在于有重要生物活性分子或药物分子结构中。例如κ1a类阿片受体激动剂Fedotozine, HIV非核苷类逆转录酶抑制剂DPC 961,抗疟疾分子Cipargamin和 V1B 类非肽型血管加压素拮抗剂Nelivaptan均含有这类结构单元(图1)。因此,手性α-三级胺片段的高效构建一直是有机化学领域中的研究热点。
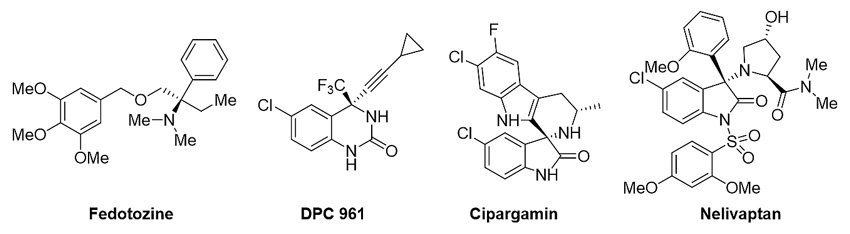
图1. 含手性α-三级胺片段的生物活性分子或药物分子
利用手性催化剂实现亲核试剂对酮亚胺的催化不对称加成来构筑手性α-三级胺无疑是一个较理想的方法。近年来,芳基硼试剂对芳基酮亚胺的不对称加成反应取得了较多的进展,但是无一例外,酮亚胺底物均需要有N-保护基才能表现出较高的反应活性和立体选择性。采用N-保护基不仅不符合原子经济性原则,并且脱除磺酰或酰胺类保护基反应条件苛刻,限制了这些方法学的实用价值(图2)。实现芳基硼试剂对无保护酮亚胺的催化不对称加成无疑是更加实用和高效的方法。
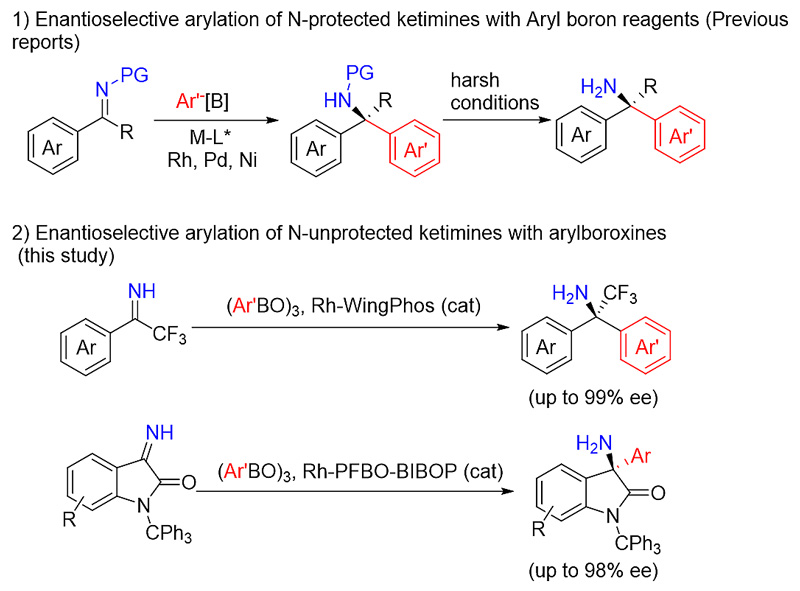
图2. 芳基硼试剂对芳基酮亚胺的不对称加成
中国科学院上海有机化学研究所汤文军研究员(点击查看介绍)及其团队开发的BIBOP型配体已经成功地应用于多类不对称催化反应。该类配体结构的独特性在于处于膦原子邻位的4,4'-取代基。4,4'-取代基的变化可以有效调节配体手性口袋的形状、深度和电性,从而打造出适合不同催化反应的手性配体(图3)。

图3. BIBOP系列配体
近日,该课题组利用手性BIBOP型配体发展了首例铑催化芳基硼酸酐对无保护亚胺的不对称加成,并实现了Cipargamin的高效不对称合成。朱金斌、黄林伟等同学通过对配体、碱和溶剂的考察,发现以铑-WingPhos为催化剂,甲苯为溶剂,氟化铯作为碱能够以优异的立体选择性和良好的收率合成一系列手性α-三氟甲基-α,α-二芳基胺。亚胺底物中的芳环的间、对位上可以容忍各类给电子和吸电子取代基,具有给电子或吸电子取代基的芳基硼酸酐均可适用,表现出优秀的对映选择性(图4)。
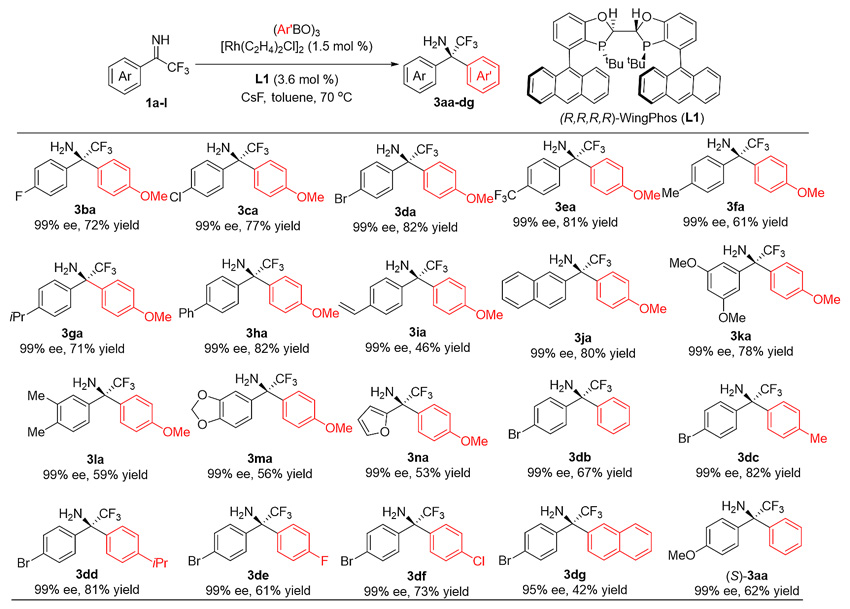
图4. 手性α-三氟甲基-α,α-二芳基胺的高效合成
研究团队还实现了铑催化芳基硼酸酐对靛红类无保护亚胺的不对称加成。他们采用PFBO-BIBOP(L6)作为手性配体,高立体选择性和高收率地获得了一系列手性3-氨基-3-芳基吲哚酮产物。一系列取代苯基硼酸酐均可适用,萘基、呋喃、噻吩等芳环均可容忍。一系列官能团化的靛红亚胺底物均可适用。值得注意的是,一个硝基取代的3-氨基-3-芳基吲哚酮5ga也能以高立体选择性地获得,一个大位阻的4-甲氧基取代手性产物5la也能顺利获得(图5)。
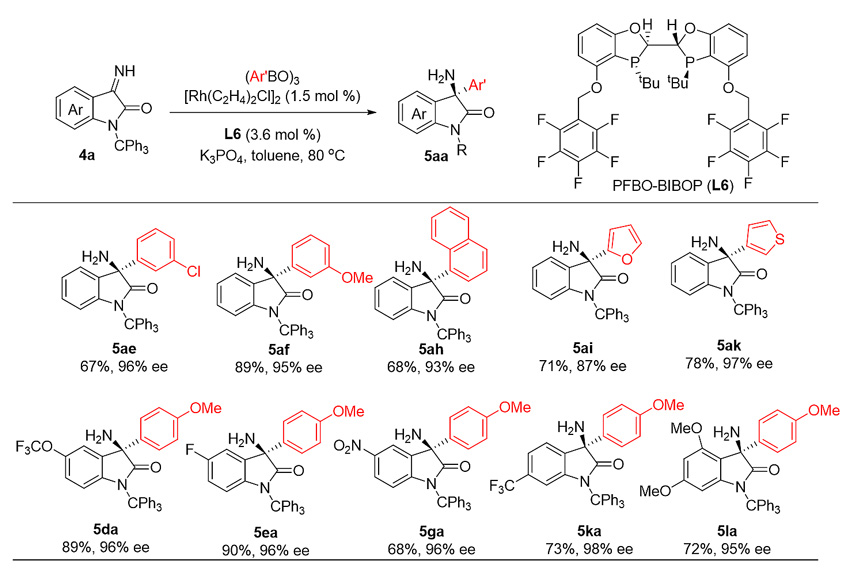
图5. 代表性的3-氨基-3-芳基吲哚酮产物
为了体现该方法学的实用性,研究团队实现了对抗疟疾活性分子Cipargamin的高效不对称合成。高官能团化的吲哚硼化合物7与亚胺8在铑-PFBO-BIBOP催化下高立体选择性地生成手性α-三级胺9。缩酮9在酸性条件下脱保护原位环合生成亚胺,随后硼烷/2-甲基吡啶条件下高非对映选择性地还原生成二级胺10。最后,三乙基硅烷/三氟乙酸条件下脱除三苯甲基保护基顺利完成Cipargamin的立体选择性合成(图6)。
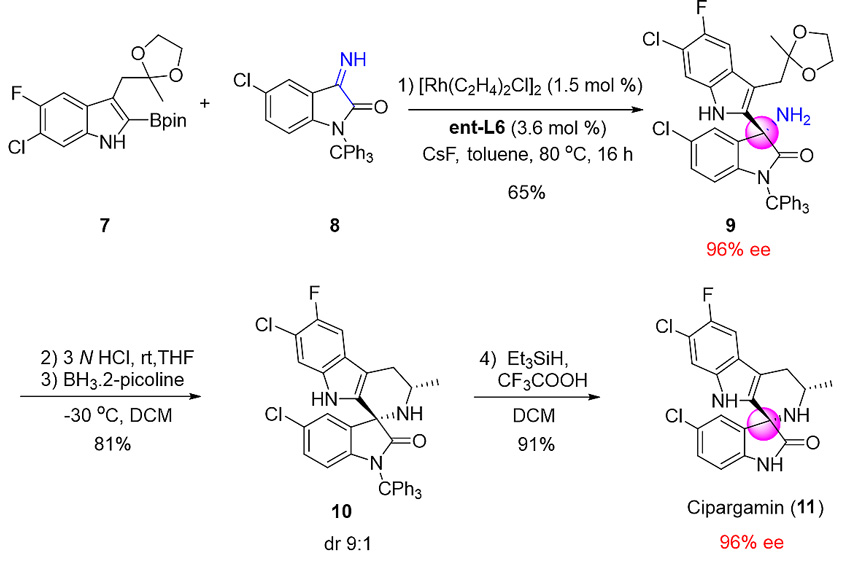
图6. Cipargamin的高效合成
相关工作发表在Angew. Chem. Int. Ed.上,第一作者是博士研究生朱金斌,该论文通讯作者是邓卫平教授和汤文军研究员。该研究工作得到国家自然科学基金委、中国科学院战略性先导科技专项(B类)、中国科学院和生命有机化学国家重点实验室的大力资助。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Enantioselective Rhodium-Catalyzed Addition of Arylboroxines to N-Unprotected Ketimines: Efficient Synthesis of Cipargamin
Jinbin Zhu, Linwei Huang, Wei Dong, Naikai Li, Xingxin Yu, Wei-Ping Deng, Wenjun Tang
Angew. Chem. Int. Ed., 2019, DOI: 10.1002/anie.201910008
导师介绍
汤文军
https://www.x-mol.com/university/faculty/15573
(本稿件来自Wiley)
 0
0












