将CRISPR/Cas基因编辑技术称为生物医学领域的“明星”,估计不会有什么反对的声音。对于生物医学领域的研究者来说,这种号称“基因魔剪”的工具高效、精准、廉价、操作简单方便,真核细胞和原核细胞都可使用,理论上任意DNA序列都可作为目标,非常强大;无论是生物医学的学术研究,还是癌症等重大或罕见疾病的临床治疗,CRISPR/Cas技术都有广泛而关键的应用。就算是对于相关专业领域之外的人们来说,CRISPR/Cas技术也是“明星”,它总与一些“大新闻”有关,为吃瓜群众提供了大量谈资,比如MIT与UC Berkeley关于CRISPR/Cas技术专利权的官司(点击阅读详细)以及后来贺某某引发的伦理之争,如此等等。在这样一个生物医学领域的“明星”面前,化学、材料学领域的研究者似乎只能围观吃瓜?别忘了,学科之间的边界从来都是用来跨越的。
这不,Science 杂志近期发表了一篇以麻省理工学院(MIT)James J. Collins教授为通讯作者的研究论文,该研究将CRISPR/Cas基因编辑技术用于刺激响应性智能材料的构建,得到了CRISPR响应性智能水凝胶。这种凝胶含有DNA为结构组件或者“货物”锚点,在接受到靶标核酸序列作为触发信号后,CRISPR相关酶Cas12a被激活并切割凝胶中的DNA,凝胶发生从分子水平到宏观水平的性质变化,从而实现对生物学信息刺激的响应。研究者用这一智能水凝胶体系实现了多种功能,比如小分子、生物大分子、纳米粒甚至细胞等“货物”的控释,通过调节电阻实现对微型电路的控制,以及与微流控芯片整合实现对病毒的快速、高精度检测。
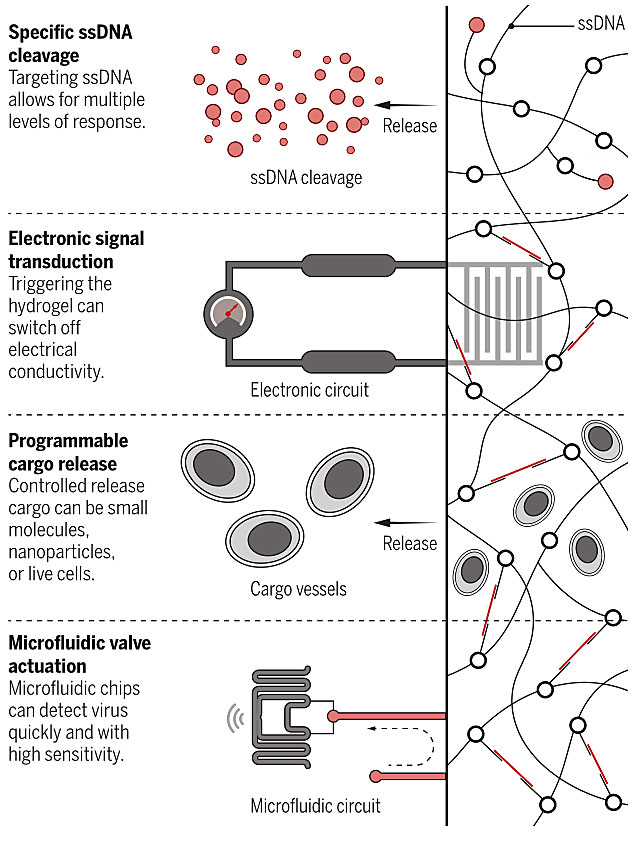
CRISPR-响应性智能水凝胶的应用。图片来源:Science [1]
在CRISPR/Cas基因编辑技术中,发挥至关重要作用的就是CRISPR相关酶Cas。本研究中使用的是Cas12a,非激活状态下并不能切割DNA;不过在与其结合的向导RNA(gRNA)特异性地识别靶标双链DNA(dsDNA)后,Cas12a会被激活,可高效切割其他作为底物的DNA。
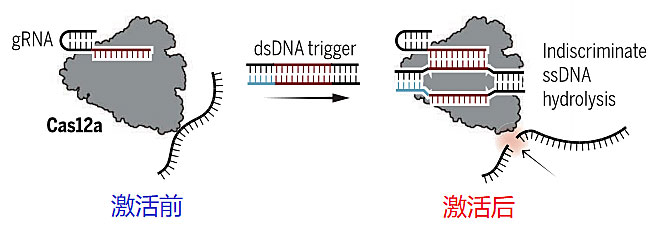
Cas12a酶激活示意图。图片来源:Science [1]
本研究的重点在于,将Cas12a的底物——DNA作为结构组件或者“货物”锚点嵌入水凝胶中,当Cas12a被激活后,能够对水凝胶中的DNA产生酶切作用,就可实现“货物”的受控释放,或者是水凝胶宏观性质的受控改变。
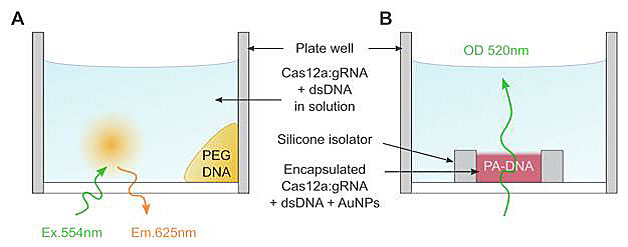
凝胶中荧光分子、纳米粒“货物”的释放实验示意图。图片来源:Science
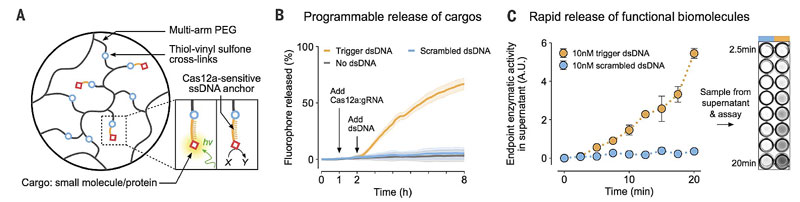
首先,他们制作了一种PEG水凝胶,用巯基将ssDNA一端固定在水凝胶中,ssDNA的另一端连接了荧光分子或者酶(两者分别代表小分子或大分子“货物”)。因为荧光分子或酶是固定在水凝胶中的,所以水凝胶放置于缓冲液中在溶液中无法检出相关信号。当在溶液中加入gRNA-Cas12a复合物后,溶液中依然无法测出相关信号,因为Cas12a此时还未被激活。接着,加入能够被gRNA特异性识别并结合的靶标dsDNA,这次很快就能在溶液中检出相关信号。这是由于将荧光分子或者酶固定在水凝胶内的ssDNA被激活的Cas12a切断,这些分子“货物”从水凝胶中释放出来进入溶液中。
PEG水凝胶中由DNA固定荧光分子或酶,并被激活的Cas12a酶切割实现受控释放。图片来源:Science
分子“货物”可以通过化学键固定于凝胶内,如果“货物”达到了纳米级甚至微米级,变成了纳米粒、细胞等更大、功能更加丰富的“货物”,用化学键固定就不是个很好的选择了。与此同时,PEG凝胶的孔径较小,不利于体积较大的“货物”释放出来。针对该问题,研究人员利用孔径更大的、由ssDNA参与交联的聚丙烯酰胺凝胶(PA)。在该凝胶中,PA的分子链之间由ssDNA通过双链杂交进行桥接。将PA凝胶浸泡于溶液中,Cas12a被靶标dsDNA激活后,会水解PA分子链之间的桥接DNA,破坏凝胶的结构,导致凝胶的交联度下降,包裹其中的纳米粒、细胞“货物”随即释放出来。

PA-DNA水凝胶中装载金纳米粒或细胞,并观察其在Cas12a酶作用下的释放。图片来源:Science
触发释放的靶标dsDNA可以千变万化,从金葡菌的甲氧西林耐药基因到万古霉素耐药基因,都可以成为触发这些“货物”释放的开关,而研究者要做的仅仅就是根据靶标dsDNA改变gRNA。不难看出,这种智能水凝胶很有希望实现精准靶向给药,比如,仅针对某一耐药菌释放某种针对性抗生素,有效打击耐药菌的同时减少诱发新耐药反应的可能。除了小分子和生物大分子,这种水凝胶还能实现纳米粒及细胞的控释,有希望兼容类似免疫疗法、纳米医药等更多治疗策略,有希望将针对性、个性化医疗推上一个新的台阶,进入智能化治疗时代。
除了释放“货物”,这种智能水凝胶还能作为“保险丝”控制材料的导电性。碳黑是一种比表面积大、球状、导电、有石墨性质的材料,将其与DNA一起进行热处理,可以通过其与DNA核苷酸上芳香基团的π-π作用形成具有良好导电性的黑色凝胶。这种凝胶与被靶标dsDNA激活的Cas12a接触后,会导致碳黑凝胶解体,凝胶内的导电通道被破坏,电阻上升。该课题组通过将碳黑凝胶与PET/Ag电极结合,成功开发出了能够直接对靶标dsDNA产生电阻响应的检测平台,可以用于对关键的dsDNA进行检测。

碳黑-DNA水凝胶将生物信号直接转化为电阻信号。图片来源:Science
PA-DNA水凝胶的生物信息响应性解交联作用不仅可以用于释放“货物”,也可以用于控制微流体芯片。基于这样一种想法,该课题组开发了基于智能PA-DNA水凝胶的便携式纸基微流控传感器来检测靶标dsDNA(下图A)。靶标dsDNA浓度越高,就会有越多的Cas12a被激活,导致越多的凝胶发生降解,使越多的缓冲溶液流入检测区域,也就得到可检测的信号。为了扩展这种策略的检测范围,作者还引入了逆转录重组酶聚合酶扩增(RT-RPA)技术,这样就可以检测靶标RNA。作为验证,他们还进行了埃博拉病毒RNA的检测。埃博拉病毒RNA通RT-RPA扩增为DNA,然后通过gRNA-Cas12a进行识别,最终实现了对埃博拉病毒RNA低至11 aM的高灵敏检测。将这一纸基传感器的输出端连接在射频装置上,甚至能够实现对检测结果的远程监控,即靶标达到一定的检出浓度后,系统会自动发出警报。这种低成本、便于实地应用、能够多点实时监测的病毒检测体系,将为疾病防控提供更加新颖有效的工具。
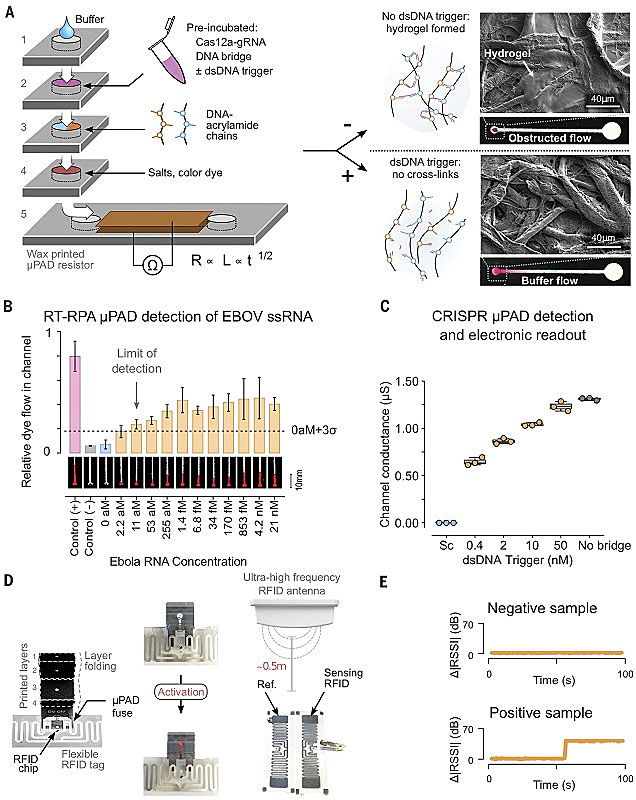
利用PA-DNA水凝胶构建微流控纸基传感器。图片来源:Science
在全文总结中作者认为,这项研究最妙的地方还是在于应用的便利程度上,因为使用者仅需要改变gRNA,就可识别新的靶标dsDNA,而水凝胶材料几乎是通用的。再加上RNA的合成已经完全商业化了,这就使得这项技术有望迅速推广到各个相关实验室,实现对各种DNA或RNA靶标的定制化响应,在疾病诊断、组织工程学、生物电子学领域都有广阔的应用空间。
最后,在这里说个Cas12a的八卦趣闻。Cas12a的小试牛刀是张锋博士在2018年初的一篇关于多通路核酸检测的论文(Science, 2018, 360, 439-444)。而与其有专利之争的女科学家, Jennifer Doudna博士对Cas12a的核酸酶特性也进行了系统性的研究与报道(Science, 2018, 360, 436-439)。今天介绍的这篇论文的通讯作者James Collins博士就职于MIT/Harvard,曾与张锋博士共同研发首个基于CRISPR的核酸检测平台SHERLOCK(Science, 2017, 356, 438-442)。笔者这里瞎猜,MIT阵营再用Cas12a发一篇Science给对方瞧瞧,某种程度上是不是算对Doudna课题组的一个“回敬”?不得不说,大牛的世界真是可怕,神仙打架刀光剑影之间飞来飞去的都是Science论文。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Programmable CRISPR-responsive smart materials
Max A. English, Luis R. Soenksen, Raphael V. Gayet, Helena de Puig, Nicolaas M. Angenent-Mari, Angelo S. Mao, Peter Q. Nguyen, James J. Collins
Science, 2019, 365, 780-785, DOI: 10.1126/science.aaw5122
参考资料:
1. Da Han, Juan Li, Weihong Tan. CRISPR propels a smart hydrogel. Science, 2019, 365, 754-755, DOI: 10.1126/science.aay4198
https://science.sciencemag.org/content/365/6455/754
(本文由传光簇供稿)
 0
0










